게피티니브정,'EGFR TK 활성 변이 국소 진행성 또는 전이성 비소세포폐암치료'로 조정
 |
오는 18일부터 게피티니브 단일제(정제)의 효능·효과가 'EGFR 활성 변이가 있는 국소 진행성 또는 전이성 비소세포폐암의 1차 치료'에서 'EGFR TK 활성 변이가 있는 국소 진행성 또는 전이성 비소세포폐암의 치료'로 허가사항이 변경된다.
또 이상반응 '혈관부종 및 두드러기를 포함하는 알레르기 반응(1.1%)'도 '흔하지 않게'서 '흔하게' 로 바뀐다.
또한 '3건의 무작위 3상 임상시험에서 보고된 알레르기 반응의 이상반응은 총 발생률이 1.5%(36명)이다. 36명 중 14명은 해당 이상반응보고서에 알레르기 병인이 없거나 다른 의약품 투여에 의한 알레르기 반응으로 빈도에서 제외됐다'는 기허가사항은 아예 삭제된다.
식약처는 '게피티니브 단일제(정제)'에 대해 안전.유효성 심사 등을 근거로 효능효과 및 사용상의 주의사항 통일조정 등 변경 지시에 앞서 17일까지 사전예고한다고 밝혔다.
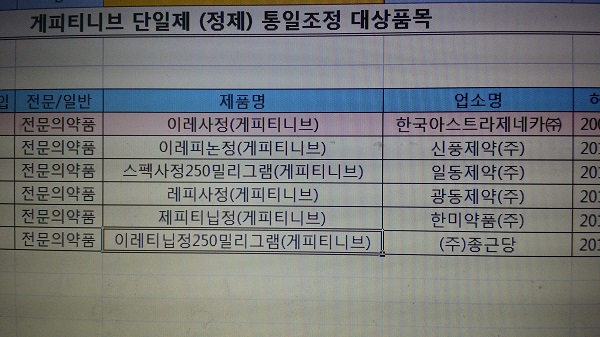
해당품목은 한국아스트라제네카㈜ '이레사정', 신풍제약(주) '이레피논정', 일동제약(주) '스펙사정250mg', 광동제약(주) '레피사정', 한미약품(주) '제피티닙정', (주)종근당 '이레티닙정250mg 둥 6품목이다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 동국제약, ‘마이핏S 혈당&핑크핏 다이어트’ 엠버서더 ‘핑크어트’ 모집
동국제약, ‘마이핏S 혈당&핑크핏 다이어트’ 엠버서더 ‘핑크어트’ 모집
