 |
㈜삼양바이오팜 '데시리드주40mg' 등 '데시타빈' 단일제의 이상반응 심근병증, 간기능 이상, 고빌리루빈혈증, 고혈당증이 보고됐다.
또 이 약을 임신중에 투여했을 경우 태아에 기형을 유발할 수 있다는 임부 및 임산부에 대한 투여 경고도 추가됐다.
식약처는 '데시타빈 단일제(주사제)'에 대해 안전·유효성 심사 등을 근거로 사용상의 주의사항을 조정할 예정이며 대상품목 보유업체는 이의가 있는 경우, 그 의견을 오는 5월1일까지 제출해 줄것을 주문했다.
데시타빈 단일제(주사제) 허가사항 변경안에 따르면 이 약의 시판 후 보고된 약물이상반응은 심장 장애:심근병증 (박출률 감소를 포함), 간 기능 이상, 고빌리루빈혈증, 대사 및 영양 장애: 고혈당증이 보고됐다.
간장애 중증신장애 환자에 이 약을 투여할 경우 주의가 요구되며 환자를 면밀히 모니터링 해야 한다.
또 이 약을 임신중에 투여하였을 경우 태아에 기형을 유발할 수 있다는 임부 및 임산부에 대한 투여경고도 신설됐다.
또한 데시타빈의 대사는 P450효소에 의한 것이 아니고, 산화탈아민화에 의해 매개되기 때문에 CYP450-매개 대사약물과 상호작용은 기대되지 않는다.
데시타빈의 미미한 In vitro 혈장단백결합(<1%)을 감안할 때 병용약물로 인해 혈장단백결합에서 데시타빈이 유리될 가능성은 거의 없다.
in vitro 연구결과 데시타빈은 약한 P-glycoprotein(P-gp) 기질이므로 P-gp 저해제와 상호작용 하지 않을 것으로 예상된다.
in vitro에서 이 약의 낮은 혈장단백결합(<1%)을 감안할 때, 데시타빈이 병용투여하는 약을 혈장단백결합에서 유리시킬 가능성은 거의 없다.
in vitro 연구에서 데시타빈은 치료적 최고혈중농도(Cmax)의 20배 이상에서 CYP450 효소를 저해하거나 유도하지 않는 것으로 나타났다.
따라서, CYP-매개 대사약물 상호작용은 기대되지 않으며 이 경로를 통하여 대사되는 약물과 상호작용할 가능성은 거의 없다.
데시타빈은 in vitro에서 P-gp매개운송의 약한 저해제 인것으로 나타났다. 따라서 병용하는 약의 P-gp 매개운송에 영향을 미치지 않을 것으로 기대된다.
이 약 조제시 약액과 피부접촉을 피하여야 하고 보호장갑을 반드시 착용하여야 한다. 세포독성 항암제 사용을 위한 표준 절차를 따르도록 한다. 1회 사용 후 사용하지 않은 약액 또는 폐기물은 국내규정에 따라 폐기하도록 한다는 적용상의 주의사항도 추가됐다.
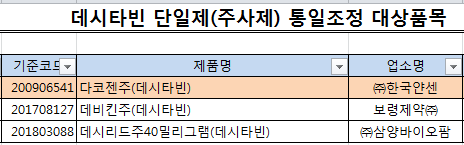
㈜삼양바이오팜 '데시리드주40mg',보령제약㈜ '데비킨주', ㈜한국얀센 '다코젠주' 등 3품목이다.
이인선 기자 eipodo@naver.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
