"유전자치료제 등 첨단바이오약 허가·심사 역량 키우겠다"
품목별 특별심사팀 구성·운영...내부 교차검토와 함께 외부 기술자문도
28일 전주기 안전관리 강화 대책 내놔
 |
 |
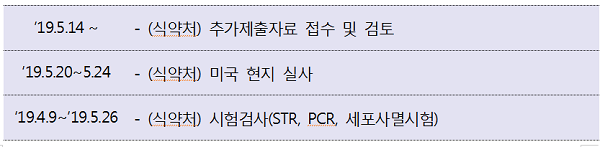 |
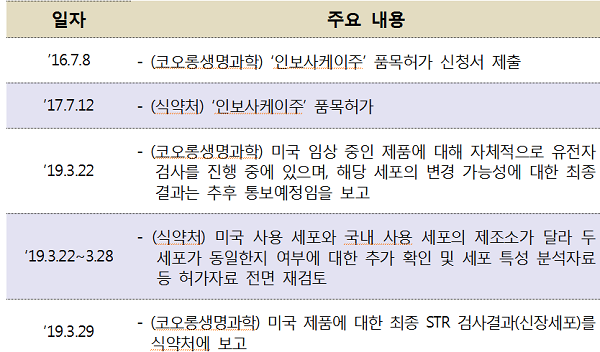
허가 당시 제출 자료가 허위로 판명난 '인보사케이주'를 허가취소하고 형사고발 예정인 식약처는 유전자치료제 등 첨단바이오의약품의 허가·심사 역량을 키우겠다며 전주기 안전관리 강화 대책을 내놨다.
28일 식약처에 따르면 번사건을 계기로 회사가 제출한 자료의 신뢰성 확보를 위하여 연구개발 단계부터 허가, 생산 및 사용에 이르는 전주기 안전관리체계를 강화하는 전주기 안전관리 체계를 구축하겠다고 밝혔다.
세포의 기원, 개발경위 및 연구용세포은행 등 연구개잘단계부터 관리를 강화하기 위해 ‘인체세포 등 관리업’을 신설해 세포의 채취부터 처리·보관·공급에 이르기까지 단계별로 안전 및 품질관리기준을 마련할 계획이다.
또 허가 신청 시 연구개발에 오랜 기간이 소요되는 신약은 개발 초기 단계에 실시된 시험자료에 재검증이 필요한 경우 최신의 시험법으로 다시 시험해 제출하도록 하고 중요한 검증요소의 경우 식약처가 직접 시험해 확인할 예정이다.
또한 세포의 혼입 가능성이 있는 경우에는 연구개발과 제조 등에 사용된 세포에 대한 유전학적 계통검사 결과를 제출하도록 할 방침이다.
생산단계에서는 첨단바이오의약품의 특성을 반영한 제조·품질관리기준 마련과 함께 점검을 강화하고, 유전학적 계통검사 실시 및 결과 보관을 의무화한다.
사용단계에서는 첨단바이오의약품의 판매·투여내역 및 이상사례 등록 등 장기추적조사를 의무화할 계획이다.
식약처는 "첨단기술 분야에 대한 심사 전담인력을 확충하고 심사 전문성을 강화하며 최초개발 신약, 첨단기술 등 보다 전문적 심사가 필요한 경우 품목별 특별심사팀을 구성·운영하고, 내부 교차검토와 함께 외부 기술자문을 실시하는 등 심층적 심사를 실시하겠다"고 밝혔다.
식약처는 이번 인보사케이주 허가 취소 사건을 엄중하게 받아들이고 있으며, 이번 사건을 계기로 앞으로 보다 안전하고 우수한 의약품이 개발·공급될 수 있도록 환자 중심의 안전관리체계를 강화하겠다고 밝혔다.
유희정 기자 y7216@naver.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 강원의대 산부인과 황종윤 교수, "‘분만실 유지 기본 수가’ 신설과 분만 의료인 지원 정책 도입 필요"
강원의대 산부인과 황종윤 교수, "‘분만실 유지 기본 수가’ 신설과 분만 의료인 지원 정책 도입 필요"
