임상시험 단계별 위험도 기반 사후관리쳬계 새로 개편도
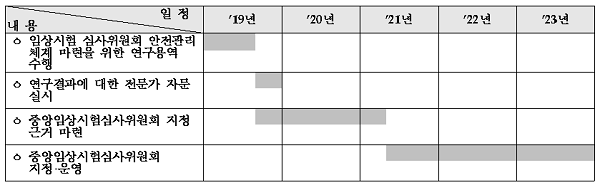 |
오는 9월 임상시험실시기관 내 상설위원회로 운영되고 있는 중앙임상시험심사위원회(IRB)의 지정 근거가 마련된데 이어 늦어도 2021년 5월부터 본격 IRB 지정·운영에 돌입할 예정이다.
9일 식약처의 임상시험 발전 5개년 종합계획에 따르면 임상시험실시기관 내 상설위원회로 운영되고 있는 임상시험심사위 운영의 독립·공정·전문성 강화를 위한 관리 체계 개선의 필요성이 제기돼 왔다.
또 임상시험에 참여하는 환자의 안전 및 권리보호를 위해 의료기관과 별도로 공공적 성격의 ‘중앙임상시험심사위’ 지정·운영을 추진키 위해 연내 안전관리 체계 마련을 위한 연구용역을 추진하고 하반기에 연구결과에 대한 전문가 자문을 거칠 예정이다.
이를 통해 하반기 9월부터 중앙임상시험심사위 지정 근거를 마련하는 한편 2021년 5월부터 중앙임상시험심사위 지정과 운영을 본격 추진할 방침이다.
또한 임상시험책임의 위반사항 발생시 책임자 소속 의료기관 처벌에서 위반 주체인 책임자 처벌로 근거 변경되는 등 임상시험 단계별 위험도 기반 사후관리쳬계가 새로 개편된다.
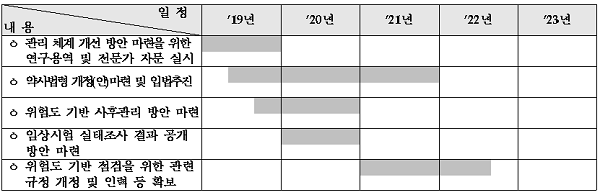 |
올해안에 임상시험 단계별 사후 관리 체계 개선 방안 마련을 위한 연구용역 및 전문가 자문 실시하고 임상시험 안전관리의 투명·신뢰성 확보를 위해 2020년에는 임상시험 실태조사 결과공개 범위 기준이 마련된다.
이어 2021년에는 임상시험 관리 전담조직인‘임상시험 안전관리 TF팀’ 구성 및 전문성 강화 방안도 마련돼 위험도 기반 점검을 위한 관련 규정 개정과 인력 확보에 나설 방침이다.
아울러 올해안에 임상시험 검체분석기관 주요 업무별 업무표준안이 마련되고 검체분석기관의 품질 향상을 위해 기관들이 업무에 참고할 수 있는 업무 표준안을 마련‧배포될 예정이다.
2020년에는 임상시험 검체분석기관의 품질향상을 위한 추가 개선방안이 마련되고 임상시험 검체분석 허브 구축방안도 2021년에 추진된다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
