 |
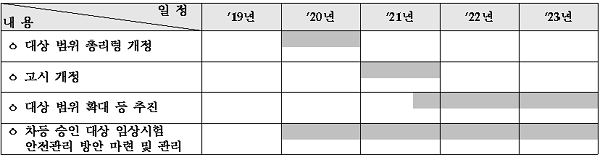
내년부터 시판의약품 등 위험도가 낮은 임상부터 차등승인제가 단계적으로 도입 추진된다.
차등승인제 도입 대상은-이미 허가된 의약품의 허가사항 범위 내 수행 약동·약력학 비교임상시험, -의약품집 발행국가에서 승인한 치료적 확증을 위한 다국가 임상시험(미국, 일본, 영국, 독일, 프랑스, 이탈리아, 스위스, 캐나다 8개국), -시판중인 항암제를 이용한 연구자 임상시험 등이 해당된다.
또 올 9월부터 초기임상시험의 원활한 진입을 위해 계획서 작성 등 초기단계부터 개발자와의 사전검토제가 활성화돼 IND(임상시험계획 승인제도)기간이 30일에서 7일로 단축된다.
9일 식약처의 임상시험 발전 5개년 종합계획에 따르면 각 국의 임상시험 우위 선점경쟁이 가속화 되고 임상시험 조기 진입을 통한 국내 환자 치료기회 확대 등 사회적 요구가 지속적으로 증대되고 있는 가운데 그간 국내 임상의 풍부한 경험 축적, 시험대상자 보호와 안전성 등을 확보한 임상시험에 대해 2020년 차등화된 승인제도가 단계적으로 도입된다.
우선 시판의약품 등 위험도가 낮은 임상부터 단계적으로 우선 추진하되 -이미 허가된 의약품의 허가사항 범위 내 수행 약동·약력학 비교임상시험 -의약품집 발행국가에서 승인한 치료적 확증을 위한 다국가 임상시험 -시판중인 항암제를 이용한 연구자 임상시험에 적용된다.
이를 위해 임상시험심사위원회(IRB) 심의요건 강화, IRB 심의결과 정기적 제출 및 상시 모니터링 절차 등 안전장치가 마련된다.
또한 임상시험 승인절차의 신속·예측성을 확보하기 위해 올 9월부터 예비.사전검토제가 활성화돼 사전검토에서 안전성 등 최종검토가 완료된 경우 IND 승인기간이 30일에서 7일로 23일 줄어든다.
기존에는 접수 5일내 신청자료 요건을 검토하고 15일내 보완사항 심사 부서에 회신했으며 20일내 최종 보완 과정을 거쳐 왔다.
임상시험 전문성 강화에도 나서 제1상 임상시험계획 중 신약은 '초기임상시험 혁신심사팀'을 통해 통합심사, 보완수준·제출자료 검토 등에 필요시 전문가 자문도 추진할 방침이다.
자문단은 주요 분야별로 10인 이내 전문가가 위촉된다.
아울러 대상자 선정·제외기준 변경, 중도탈락 기준의 완화, 임상약의 투약방법 또는 기간의 변경 등 기존 임상시험계획서 변경승인 사항이 보고 대상으로 전환되며 다만 변경사항에 대한 검토가 필요한 경우 사전검토제가 활용된다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 강원의대 산부인과 황종윤 교수, "‘분만실 유지 기본 수가’ 신설과 분만 의료인 지원 정책 도입 필요"
강원의대 산부인과 황종윤 교수, "‘분만실 유지 기본 수가’ 신설과 분만 의료인 지원 정책 도입 필요"
