73개 진단시약 제품 수출용으로 허가-유전자 50개, 면역 23개
美-이탈리아 등 110여개국에 약 5646만명분(5월19일 기준) 진단시약 수출
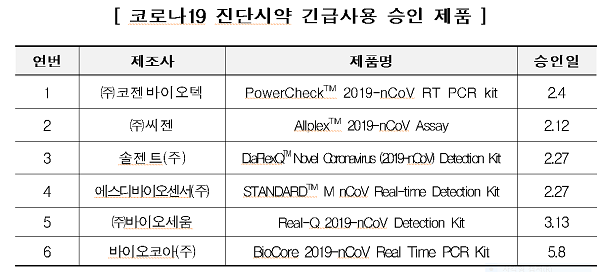 |
코로나19 발발 이후 서류평가, 임상성능평가, 전문가 회의 등을 신속 진행를 통해 총 6개 진단시약 제품이 긴급 승인됐고 현재 10개 제품이 임상성능평가가 진행 중인 것으로 확인됐다.
25일 코로나19 진단시약 긴급사용 승인 제품에 따르면 ㈜코젠바이오텍 'PowerCheckTM 2019-nCoV RT PCR kit'(2월4일), ㈜씨젠 'AllplexTM 2019-nCoV Assay'(2월12일), 솔젠트(주) 'DiaPlexQ™ Novel Coronavirus (2019-nCoV) Detection Kit'(2월27일), 에스디바이오센서(주) 'STANDARDTM M nCoV Real-time Detection Kit'(2월27일), ㈜바이오세움 'Real-Q 2019-nCoV Detection Kit'(3월13일), 바이오코아(주) 'BioCore 2019-nCoV Real Time PCR Kit'(5월8일) 등이다.
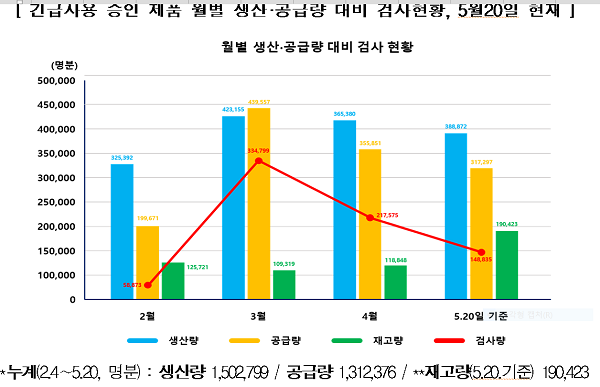
국내 긴급사용 승인 6개 제품은 1일 최대 생산량은 약 15만명분으로 5월20일자 누적 총생산량은 150만명분이다. 5월20일 기준 국내에는 이 중 131만명분이 공급됐고 지금까지 총 76만건의 검사를 진행했으며, 현재 약 19만명분을 재고로 확보해 안정적인 수급을 이어가고 있다는 것이다.
현재 식약처는 질병관리본부와 협의해 검체 전처리부터 결과 도출까지 1시간 이내로 분석 가능한 ‘응급용 유전자 진단 시약’에 대한 긴급사용 승인 절차 및 기준을 마련했다고 밝혔다.
기존 긴급사용 승인 제품이 진단에 6시간이 걸리는데 비해 응급진단시약은 검사시간을 1시간 내로 단축해 응급수술 등 시급한 조치가 필요한 환자에 대한 긴급검사 목적으로만 사용할 예정으로 신청접수 시 임상성능평가, 전문가 검토 등을 거쳐 일정수준 이상 성능기준을 충족한 제품을 신속 승인할 예정이다.
 |
신청접수 시 임상성능평가, 전문가 검토 등을 거쳐 일정수준 이상 성능기준을 충족한 제품을 신속 승인할 예정이다.
한편 20일 기준 73개 제품이 수출용으로 허가(유전자 50개, 면역 23개)돼 미국, 이탈리아, 브라질, 사우디아라비아, 이집트, 인도네시아 등 110여개국에 약 5646만명분(5월19일 기준)의 진단시약을 수출하고 있다.
특히, 우리나라 진단시약 7개 제품은 美FDA의 긴급사용승인을 받아 미국 등으로의 진출이 더욱 확대될 것으로 전망된다.
식약처는 아울러 정식허가 전환으로 품질 신뢰도를 높이겠다고 밝혔다.
또 긴급사용 승인 제품과 수출용 허가 제품의 정식허가로의 전환을 통해 K-진단시약의 품질에 대한 글로벌 신뢰도를 높여 나갈 예정이며 이를 위한 단계별 밀착 지원도 강화하겠다고 설명했다.
이를 위해 신청 준비단계에서는 허가도우미를 활용, 맞춤형 컨설팅을 지원해 허가 신청서류 준비기간은 30일→7일로 단축하고 임상시험 가이드 제공과 계획서 신속 승인으로 임상시험 개발과 시험실시 기간도 90일→22일 이내로 줄인다.
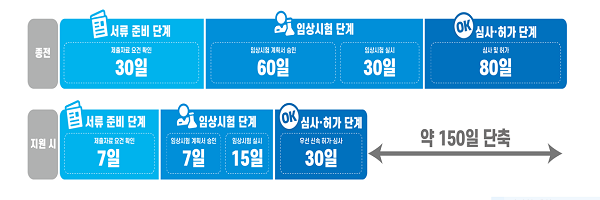 |
이어 심사·허가단계에서는 허가심사 가이드라인 제공과 우선 허가·심사대상 품목으로 선정으로 기간을 80일→30일 이내로 단축할 방침이다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
