 |
앞으로 생명을 위협하는 질환 또는 신종 감염병 치료약 등의 신속 허가 심사 절차에 사전상담과 신속심사 프로세스가 적용되면 처리기간이 의약품은 1/4, 첨단의료기기는 1/2로 대폭 단축될 전망이다.
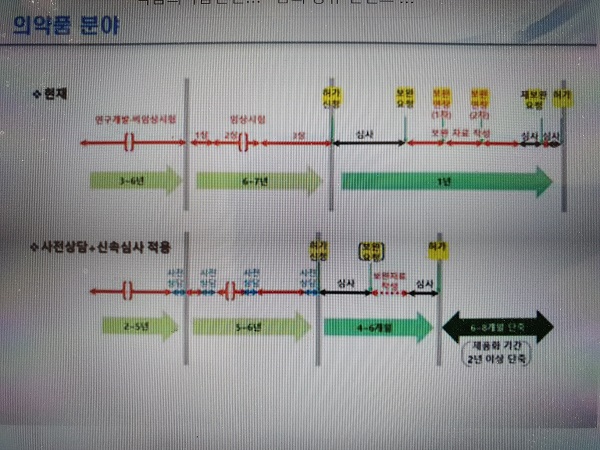
10일 식약처에 따르면 처내에 사전상담과 신속심사과 신설을 통한 처리기간 단축에 나서 신약의 법정 처리 기간인 120일을 90일로 앞당기로 첨단의료기기는 법정 처리기간인 80일에서 40일로 줄여나갈 방침이다.
또 처리기간 장기화의 주 원인인 보완기간 장기화는 사전상담을 통한 허가 신청 자료의 완성도를 높여 해결해 나갈 계획이다. 즉 임상시험 단계, 허가 신청전에 다음 단계 진입에 필요한 자료 상담을 통해 시행착오를 최소화하고 자료의 완결성을 확보한다는 것이다.
이에 따라 기존 3~4년 걸리던 연구개발 및 비임상시험 기간이 사전상담+신속심사 적용시 최소 2~5년으로 감축되고 최소 6~7년 소요되던 임상1상~3상 기간도 5~6년으로 줄어들 공산이 크다. 또한 1년 걸리던 심사-보완자료작성-재조완요청 기간은 4~6개월로 대폭 줄어들어 전체적으로 제품화 기간이 2년 이상 단축될 것으로 보여진다.
식약처는 "현행 의약품, 생물학적제제, 한약제제, 의료기기 허가 심사 규정에 따른 신속심사를 운영이나 대상 및 절차가 명확하지 않고 전담 수행부서의 미비라는 단점을 갖고 있었다"며 "미국, 유럽, 일본에서도 생명을 위협하는 질환이나 중대 질환의 치료제 등에 대해 신속심사 프로그램을 운영중에 있음을 감안해, 국내도 이들에 대한 신속 허가 심사 제도를 도입할 것"이라고 밝혔다.
 |
다만 신속심사 대상으로 지정받은 의료제품이 -거짓이나 그밖의 부정한 방법으로 지정 받은 경우 -후속임상 등에서 신속심사 지정 기준에 충족되지 않은 결과가 나타난 경우 지정통보 받은 자는 이러한 사실을 품목허가 신청전까지 식약처에 보고해야 하는 경우는 지정 취소된다고 설명했다.
이를 위해 지난 8월31일 '식약처 직제시행규칙'과 9월1일 '의료제품 신속심사 운영방안' 관련법 시행을 통한 신속심사 전담부서(신속심사과) 신설과 이 부서서 수행하는 신속심사 대상과 절차를 마련한 바 있다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
