JAK, 65세 이상-심혈관계 고위험군-악성종양 고위험 환자 사용상의 주의사항 변경
기존 치료제로 효과 불충분한 경우에 한해
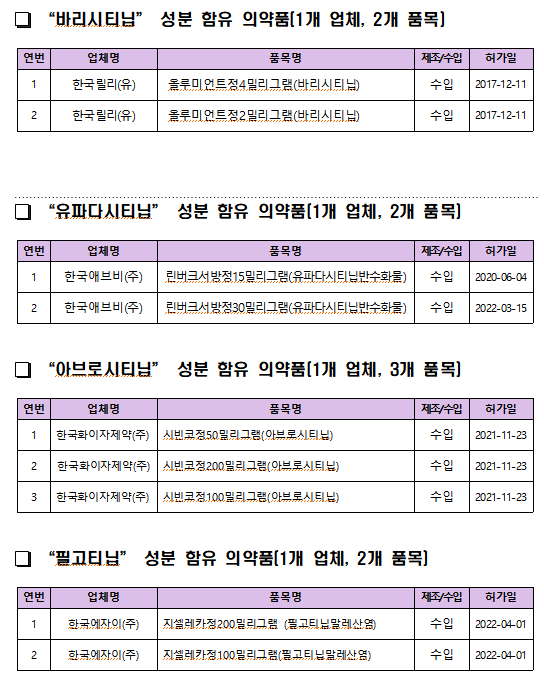
식품의약품안전처(처장 오유경)는 염증성 질환 치료제 한국화이자제약(주) '젤잔즈정5mg'(토파시티닙시트르산염), '시빈코정50mg'(아브로시티닙), 한국릴리(유) '올루미언트정4mg'(바리시티닙), 한국애브비(주) '린버크서방정15mg'(유파다시티닙반수화물), 한국에자이(주) '지셀레카정200mg'(필고티닙말레산염) 등 야누스키나제(이하 JAK) 억제제에 대해 ▲65세 이상 ▲심혈관계 고위험군 ▲악성종양 고위험 환자는 기존 치료제로 효과가 불충분한 경우에 한해 사용토록 사용상의 주의사항 변경을 추진한다.
이는 바라시티닙의 경우 해외 시판후 관찰연구 중간 분석 결과 토파시티닙, 바리시티닙 성분을 투여한 심혈관계 위험 요인이 있는 환자에서 TNF 억제제 투여군 대비 심혈관계 이상반응 등 발생 위험성이 증가함을 확인됐다. 특히, 국내 장기 추적 관찰 연구에서도 토파시티닙에 대한 사망 등 관련 위험성이 증가함을 확인된데 따른 조치다.
또 지난해 9월 ‘의약품 안전성 서한’을 배포한 후 진행된 안전성 검토 결과에 따른 후속 조치로 의견조회 절차를 거쳐 7월 중허가사항을 변경하도록 명령할 계획이다.
의약품 안전성 서한 주요 내용에 따르면 토파시티닙, 바리시티닙, 유파다시티닙 등 3개 성분이 심장마비 등 중증 심장 관련 질환 발생 위험을 증가시킬 수 있음을 알렸다.
식약처는 "이번 조치를 위해 ▲美·유럽에서 실시한 토파시티닙·바리시티닙 성분 제제 시판 후 조사 결과 ▲대한의사협회 등 전문가 단체 의견 ▲美·유럽 등 해외 규제기관의 조치사항을 종합해 중앙약사심의위원회와 전문학회의 자문을 받았으며, 최근 실시한 국내 이상사례 분석 결과도 검토했다"며 "미국의 경우 모든 JAK 억제제는 대체제가 없는 환자 등에만 제한적 사용되고 있으며 유럽에서는 토파시티닙만 고위험군에 제한적 사용, 나머지 JAK 억제제는 추가 검토가 진행되고 있다.
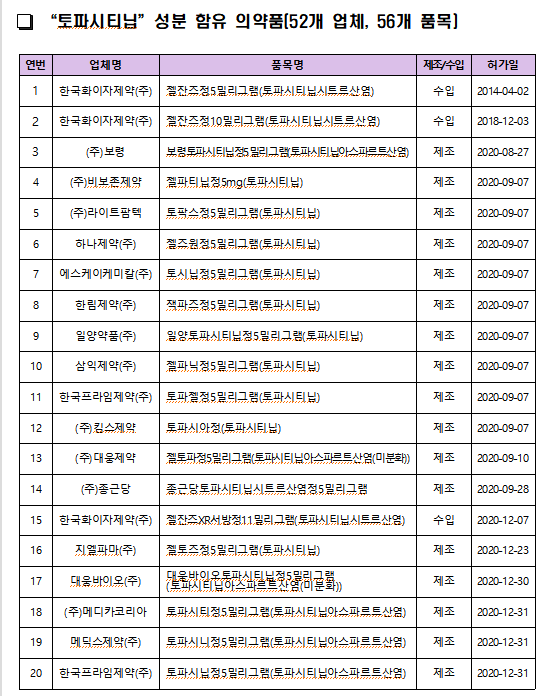
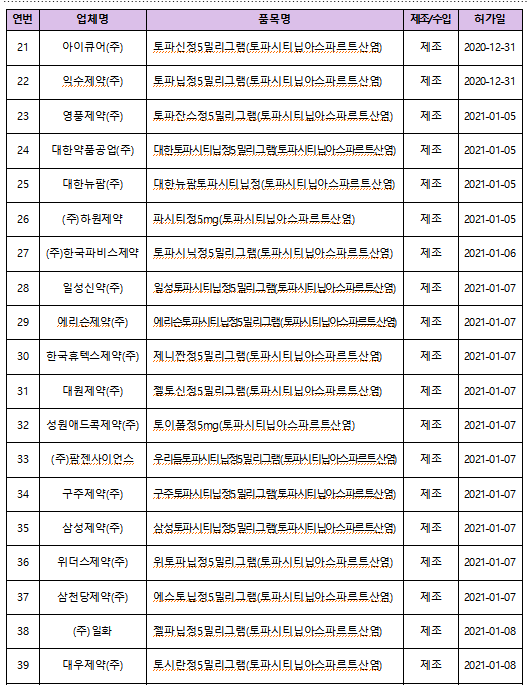
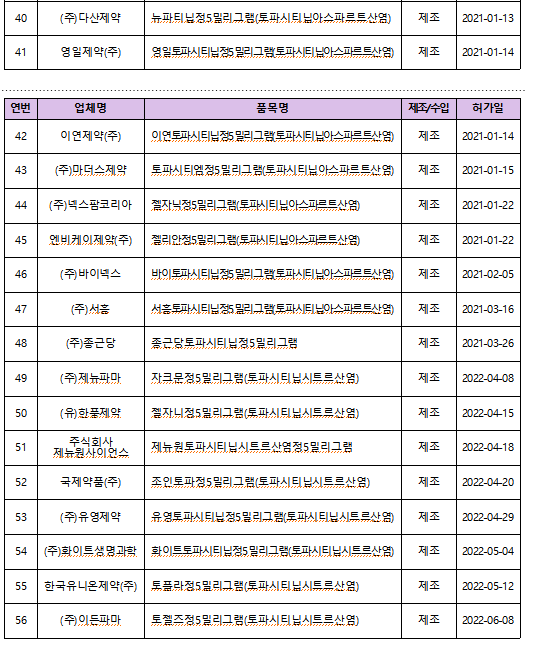
야누스키나제는 면역·염증을 조절하는 효소인 JAK의 작용을 차단해 염증을 줄여 류마티스 관절염 등 치료에 사용되며, 국내에는 토파시티닙, 바리시티닙, 유파다시티닙, 아브로시티닙, 필고티닙 등 5개 성분, 65개 품목이 허가돼 있다.
 |
 |
 |
 |
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 동국제약, ‘마이핏S 혈당&핑크핏 다이어트’ 엠버서더 ‘핑크어트’ 모집
동국제약, ‘마이핏S 혈당&핑크핏 다이어트’ 엠버서더 ‘핑크어트’ 모집
