변경허가 받지 않고 첨가제 임의 사용-제조기록서 거짓 이중작성·폐기 등 혐의
다만 '데파스정0.25mg', '베자립정', '유리토스정', '프리그렐정' 등 4품목, 시중 유통제품 사용 허용키로
21일 식약처 `의약품 GMP 특별 기획점검단`, 불시 점검 결과 발표
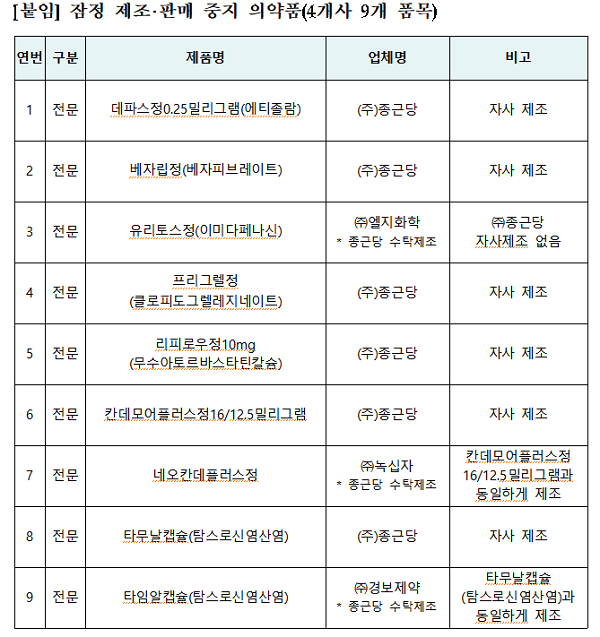 |
식약처는 21일 4개 업체에 대한 점검을 완료하고 변경허가를 받지 않고 첨가제를 임의 사용하는 등 '약사법' 위반 사례가 확인된 ㈜종근당의 '데파스정0.25mg', '베자립정', '유리토스정', '프리그렐정', '리피로우정10mg', '칸데모어플러스정16/12.5mg', '네오칸데플러스정', '타무날캡슐', '타임알캡슐' 등 9개 제품에 대해 잠정 제조‧판매 중지 등 조치했다고 밝혔다.
이는 식약처 의약품 GMP 특별 기획점검단이 4월 5일부터 현재까지 실시한 의약품 제조업체 특별 불시 점검 결과다.
식약처는 ㈜종근당에 대한 특별점검 결과 ➊변경허가를 받지 않고 첨가제 임의 사용, ➋제조기록서 거짓 이중작성·폐기 ➌제조방법 미변경 ❹원료 사용량 임의 증감 등 '약사법' 위반 사항을 확인해 ㈜종근당에서 제조(수탁제조 포함)한 9개 의약품에 대해 잠정 제조‧판매 중지 등 조치했다는 것이다.
종근당이 식약처의 점검에 대비해 원료 계량부터 제조완료까지 모든 공정을 허가받은 사항과 동일한 양식의 제조기록서를 사용해 거짓으로 작성하고, 실제 제조에 사용한 기록 등은 제조 후 폐기처분한 혐의다.
다만 식약처는 9개 의약품 중 `공급 중단 보고대상 의약품`에 해당하는 '데파스정0.25mg', '베자립정', '유리토스정', '프리그렐정' 등 4개 품목에 대해 ➊의료상 다른 의약품으로 대체가 어려운 점 ➋수거‧검사한 결과 함량 등은 시험기준 내에 있다는 점 등을 고려해 중앙약심위 전문가 자문 의견 등을 종합적으로 검토한 결과 환자 치료상 필요성 등이 인정되는 '데파스정0.25mg', '베자립정', '유리토스정' 등 3개 품목에 대해 잠정 제조‧판매 중지 조치는 적용하되 시중 유통제품 사용은 허용키로 결정했다고 말했다.
식약처는 그 외 '리피로우정10mg', '칸데모어플러스정16/12.5mg', '네오칸데플러스정', '타무날캡슐', '타임알캡슐', '프리그렐정' 등 6개 품목에 대해서는 의‧약사 등 전문가에게 해당 제품은 다른 대체 의약품으로 전환하고 제품 회수가 적절히 수행될 수 있도록 협조를 요청하는 안전성 속보를 의‧약사 및 소비자 등에게 배포했다.
식약처는 보건복지부 및 건강보험심사평가원을 통해 병·의원 등에 해당 품목의 처방이 제한되도록 요청했다.
식약처는 또 미생물 한도시험에 사용하는 배지의 성능시험 미실시 등 의약품 제조 및 품질관리기준 위반이 확인된 1개 업체에 대해 행정처분 등 조치할 예정이다. 나머지 2개 업체는 점검결과는 '약사법' 위반사항이 발견되지 않았다고 밝혔다.
식약처는 "'의약품 GMP 특별 기획점검단'의 의약품 제조소 불시 점검을 연중 실시하고 그 결과는 투명하게 공개하며 신속하게 필요한 조치를 해 나가고 고의적 제조방법 임의변경 제조, 허위‧이중 기록 작성 등 위법 행위에 대해서는 GMP 적합판정을 취소하고, 해당 위반행위를 통해 얻은 부당한 이익에 대해 징벌적 과징금을 부과하도록 '약사법'개정 등을 추진하겠다"고 말했다.
이인선 기자 eipodo@naver.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
