인과성 평가 항목 230여개 세분화
약물 이상반응 관련 용어를 국제의약용어(MedDRA)로 통일
시판 후와 임상 단계의 부작용 보고체계 일원화
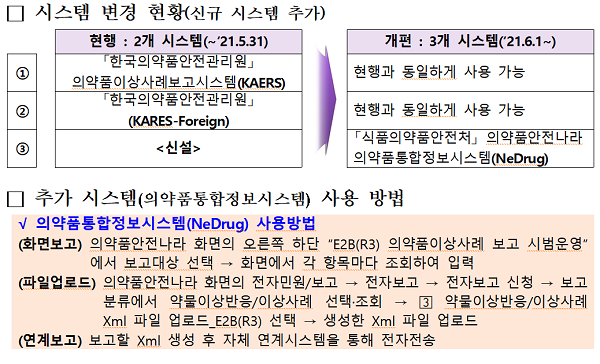 |
식품의약품안전처(김강립 처장)는 의약품 부작용 정보를 체계적으로 관리하기 위해 6월부터 의약품 부작용 보고 국제표준서식 'E2B(R3)'을 적용한 ‘의약품 부작용 보고 선진화 시스템’을 시범 운영한다.
E2B(R3)은 국제의약품규제조화위원회(ICH)에서 개별 부작용 보고서를 전자적으로 전송하기 위해 도입한 국제 표준서식.
이번 시범 운영 시스템에 적용하는 주요 내용은 ▶부작용 보고 항목에 인과성 평가를 위한 주요 항목을 추가해 종전 88개에서 230여개로 세분화 ▶약물 이상반응 관련 용어를 국제의약용어(MedDRA)로 통일 ▶시판 후와 임상시험 단계의 부작용 보고체계 일원화 등이다.
국제의약용어(MedDRA)는 ICH에서 발간하며, 전세계적으로 의약품 임상시험 및 시판 후 이상사례 보고 등에 사용하는 표준화된 용어다.
식약처는 그간 의약품 부작용 보고 시스템 도입을 위해 지난 2018년12월 국제표준서식 'E2B(R3)' 적용 시스템을 구축해 시스템 안정화 기간(2019년1월)을 거쳐 이번 시범 운영을 시작하게 됐다. 시범 운영 기간 동안은 기존 보고시스템과 새로운 시스템이 함께 병행해 운영될 예정이다.
식약처는 "의약품은 정상적으로 투여하거나 사용하더라도 예상하지 못한 부작용이 발생할 수 있어 우리나라를 포함한 미국, 유럽, 일본 등에서도 발생한 부작용을 면밀하게 검토·분석해 시판중단, 회수, 사용 시 주의사항 안내 등 환자 안전 조치를 하고 있다"며 "이번에 개선된 시범 운영 시스템 적용으로 대량의 부작용 정보 관리가 자동화·표준화되고 부작용 정보 분석이 용이해져 유의미한 부작용 정보를 신속·정확하게 탐지하는 것이 가능해진다"고 말했다.
식약처는 이번 국제표준서식 'E2B(R3)' 적용 시스템 시범 운영으로 의약품 시판 후 안전관리가 보다 강화할 것이라고 밝혔다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
반복해서 떠오르는 생각(강박사고)이 일상을 방해한다면(?)
