합성항원백신, 'SK바이오사이언스(임상1/2상)'-'유바이오로직스(임상 1상)'
DNA백신, '제넥신(임상 1/2a상)'-'진원생명과학(임상 1상)'
바이러스벡터, '셀리드(임상 1/2a상)'
보건복지부, 각 기업별 국내 임상 추진 현황-계획 공개
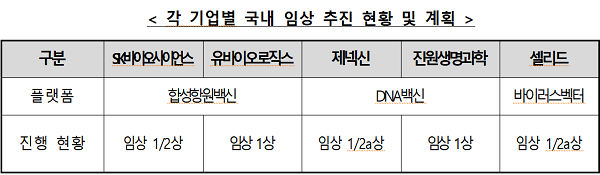 |
현재 국내에서 코로나 백신 개발을 위한 임상 시험을 진행하고 있는 곳은 5개社며 모두 임상 1상 접종을 완료한 것으로 나타났다
9일 보건복지부가 공개한 각 기업별 국내 임상 추진 현황 및 계획에 따르면 -합성항원백신=
SK바이오사이언스(임상1/2상), 유바이오로직스(임상 1상), -DNA백신=제넥신(
임상 1/2a상), 진원생명과학(임상 1상), -바이러스벡터=셀리드(임상 1/2a상) 등 5개사다.
이중 일부 기업은 임상 2상 참여자 모집을 완료하고, 빠르면 올해 7월부터 단계적으로 임상 3상 진입을 목표로 하고 있다.
복지부는 "국내 백신 개발 지원을 위해 지난 5월부터 관계부처 합동으로 '범정부 코로나19 백신 치료제 임상시험 지원 TF'를 주 1회 운영, 기업별 진행 상황을 공유하고 부처별 준비상황 등을 지속 점검하고 있다"며 "국내 백신이 신속하게 개발될 수 있게 총력 지원할 계획"임을 밝혔다.
이를 위해 우선 신속한 임상 3상 진행을 위해 국가 지정 중앙임상시험심사위원회(중앙 IRB)를 조기에 가동한다.
당초 제약사가 여러 의료기관에 걸쳐 임상 시험을 실시하는 경우 각각의 의료기관별로 임상시험심사위원회(기관 IRB)의 승인을 받는 등 임상시험 시작이 늦어지는 불편함이 있었다.
이에 정부는 국내 백신 임상 3상 계획에 맞추어 불필요한 행정력 낭비를 최소화하고, 임상 시험을 보다 신속하게 진행할 수 있도록 국가 지정 중앙임상시험심사위원회(중앙 IRB)를 도입해 금년 6월 시범 가동을 거쳐 7월부터 본격 가동할 계획이다.
임상 3상 진행에 따른 위험 분산 및 기업 비용 부담 경감 등을 위해 임상 3상 지원 R&D 예산을 추가로 확보(내부 절차 진행 중)하고, 개발 성과가 어느 정도 가시화되는 경우 국산 백신 선구매도 적극적으로 추진한다.
대부분의 국내 개발 기업들이 비교 임상 방식으로 임상 3상 추진 예정인 점을 감안해, 정부는 비교 임상이 원활하게 이루어질 수 있도록 표준 물질 확보 및 표준시험법(SOP) 확립, 대조 백신 확보 등 관련 준비에도 만전을 기할 계획이다.
아울러 임상 시험 참여자에 대해서는 임상 시험이 종료(위약군)되거나, 개발 중단․실패 시(투약군 포함) 우선 예방접종을 실시할 계획이다.
이인선 기자 eipodo@naver.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 심사평가원-원주시노인종합복지관, 아동-어르신 세대 공감 프로젝트 운영 협약 체결
심사평가원-원주시노인종합복지관, 아동-어르신 세대 공감 프로젝트 운영 협약 체결
