무진행생존기간에 대한 우수한 효능 결과 최초 공개
 |
| 초록집 |
유한양행 (대표이사 이정희)의 비소세포폐암 치료제 신약인 레이저티닙 (lazertinib, YH25448)의 임상1/2상 시험에 대한 최신 업데이트 결과가 미국임상종양학회(ASCO) 연례 학술대회에서 공개될 예정이다.
이번 결과는 2019년 6월 2일 포스터로 발표될 예정이며, 발표에 앞서 5월 16일 초록이 공개됐다.
레이저티닙은 '상피세포성장인자수용체(EGFR) 유전자'에 기존 치료제 투여 후 발생한T790M 돌연변이가 있는 국소 진행 또는 전이성 비소세포폐암에 대한 표적 치료제이다.
비소세포폐암 환자 중 EGFR 유전자 돌연변이 환자 비중은 서양인의 경우 10%~15%, 동양인의 경우 30%~40%에 이를 정도로 빈번히 발생한다.
레이저티닙의 임상1/2상 시험은 EGFR 유전자에 돌연변이가 있는 127명의 비소세포폐암 환자가 참여했다.
이번 최신 결과의 초록에서 치료 기간의 중앙값은 9.7 개월이었고, 모든 환자에서 연구자 평가에 의한 객관적반응률(ORR)은 60%, T790M 돌연변이 양성 환자에서 64%, T790M 돌연변이 음성 환자에서 37%를 나타냈다.
측정 가능한 뇌병변이 있는 환자의 두개내 병변에 대한 객관적반응률은 50%로 나타났다.
이번 발표에는 무진행생존기간 (PFS) 결과를 처음 공개하였는데, 모든 환자에서 8.1 개월, T790M 돌연변이 양성 환자에서 9.5개월, T790M 돌연변이 음성 환자에서 5.4개월을 나타냈다.
특히, 레이저티닙 120mg이상의 용량을 투여한 환자들을 대상으로 한 추가 분석에서 무진행생존기간은 12.2개월로 늘어났다. 현재 임상2상은 240mg용량에서 진행하고 있다.
이번 초록에는 안전성에 대한 최신 결과도 함께 발표하였는데, 가장 빈번히 발생한 이상 반응은 가려움증 27%, 발진 24%, 변비 20%, 식욕 감소 19%, 설사 14%로 나타났고, 이상반응으로 인해 투여를 중단한 환자는 전체의 3%, 레이저티닙 투여와 관련 있는 3등급 이상의 이상반응 3% 수준이었다.
이번 최신 발표에서 공개된 객관적반응률 결과는 작년 미국임상종양학회에서 처음 공개한 수치와 유사한 수준이며, 무진행생존기간에 대한 결과는 최초 보고로서 우수한 결과로 평가되고 있어, 치료 효과 및 안전성을 다시 한번 확인했다고 할 수 있다.
레이저티닙은 지난 2018년 11월 글로벌 제약사인 얀센사에 기술 이전 되었으며, 계약금은 5000만달러, 기술 수출 총액은 12억 5500만 달러이다.
* 객관적 반응률 (objective response): 종양의 크기가 30% 이상 감소를 보인 환자의 비율
* 무진행 생존기간 (progression-free survival): 질병이 진행되지 않거나 혹은 사망에 이르지 않는 기간
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

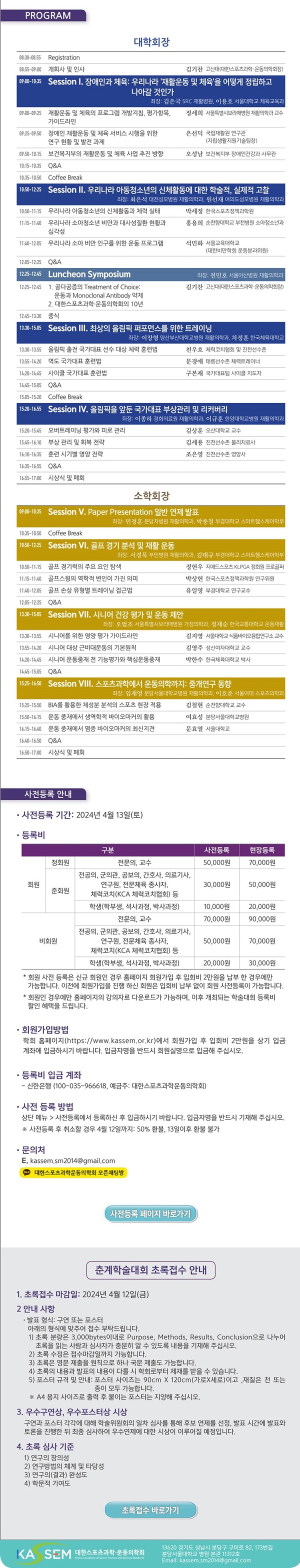 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
