28일부터 희귀암 'BIA-ALCL'의심되는 유방 보형물 이식환자 즉시 등록키로
식약처, 29일 '인공유방 이식환자 안전관리 대책' 내놔
 |
28일부터 희귀암 'BIA-ALCL(역형성 대세포 림프종)'이 의심되는 유방 보형물 이식환자를 즉시 등록하고 내년부터는 전체 인공유방의 BIA-ALCL외 부작용에 대해 모니터링이 지속적으로 추진된다.
식약처는 29일 이같은 내용의 '인공유방 이식환자 안전관리 대책'을 내놨다.
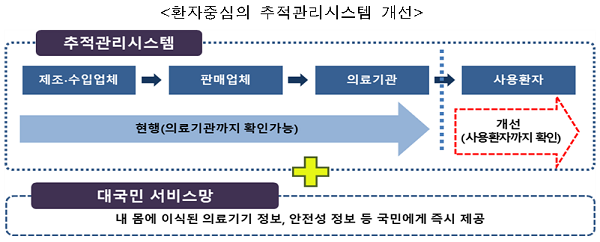
'인공유방 이식환자 안전관리 대책'에 따르면 28일부터 BIA-ALCL이 의심되는 유방 보형물 이식환자를 등록해 검진결과 등을 즉시 추적관리와 분석‧평가가 가능하도록 했다.
즉 BIA-ALCL 확진인 경우 수술방법, 수술내역, 제품정보 등 추적관리하고 BIA-ALCL이 아닌 경우 지속적인 부작용 관리에 돌입한다.
이어 내년부터는 의료기관 및 제조‧수입업체와 함께 전체 인공유방의 BIA-ALCL외 부작용에 대해서도 모니터링 등 지속할 방침이다.
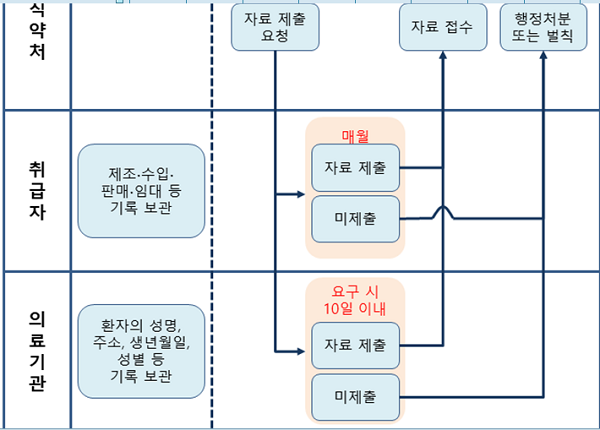
내년 9월까지 해당 환자를 즉시 파악하기 위해 의료기관의 의료기기 사용기록을 매달 보고하도록 의무화가 추진된다.
현행 업체는 매달 유통기록 보고, 의료기관은 요청 시 10일 이내 제출하고 다만 유통량, 부작용 보고 등을 고려해 단계별로 적용키로 했다.
이울러 내년말까지 환자가 내 몸에 이식된 제품에 대한 정보, 대상제품에 대한 안전성 정보 등을 직접 확인할 수 있는 창구도 마련한다.
 |
식약처는 의료기기 추적관리시스템 고도화 비용 3억8100만원을 내년도 정부예산안에 이미 반영한 바 있다.
식약처는 신속한 안전조치를 위해 부작용 보고창구 일원화를 추진하기 위해 현재 17개 권역별로 운영되는 의료기기 모니터링센터를 30개로 단계적으로 확대하고 내년말까지 추적 연구 중심의 감시체계를 위한 환자등록제도 법적 근거도 마련된다.
현행 의료기기법 제31조(부작용 관리) 및 제43조(의료기기안전정보원의 사업)에 따라 심혈관분야, 진단검사분야 등 품목별‧진료분야별 분석‧평가 전문인력 확보에도 전력을 쏟을 예정이다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 종근당, 2024 World IT Show에서 ‘메타버스 팩토리’ 공개
종근당, 2024 World IT Show에서 ‘메타버스 팩토리’ 공개
