건약 "보툴리눔톡신 제제 생산社 전 제품 재검토해야"
“피해를 입은 환자에 대한 식약처 대응이 빠져있어"
"불량 보톡스의 유통 판매 책임, 오로지 메디톡스에만 있나"
건약은 ‘메디톡신주’ 등 3개 품목의 식약처 허가 취소와 관련 “해당 제약사의 일벌백계만 내세울게 아니라 고질적인 허술한 허가규제 문제라는 본질부터 스스로 점검할 것을 강력 주문했다.
 |
또 ”관련 제품들을 전면 재검토 하라“며 ”최대한 빠른 시일내에 문제 제품을 투여받은 환자를 위한 제대로 된 가이드라인을 제시할 것“을 촉구했다.
건약은 19일 '인보사보다 심각한 메디톡신 사태, 식약처는 반성하지 않았다'는 제목의 성명을 통해 이같이 성토했다.
"식약처는 규제실패에 대해 철저히 고백하고 반성해야 한다"는 건약은 "책임을 전적으로 제약사에게 돌리거나 안전성 우려가 없다는 식으로 넘어가선 안 된다"며 "전문가 자문을 받았던 중앙약사심의위원회 회의록을 공개하지 않아 문제를 은폐하려 한다는 의혹에도 해명해야 한다"고 맹공을 퍼부었다.
그리고 "세계적으로 상업화된 보툴리눔 톡신 제제를 생산하는 회사 15개 중 한국 회사만 8개에 달한다. 가장 규모가 크고 오래됐던 메디톡스의 문제가 다른 회사에 없다고 보장할 수 없다"며 "보툴리눔톡신 제제를 생산하는 회사 전 제품들에 대한 재검토도 이뤄져야 한다"고 압박했다.
그러면서 “설령 환자 안전 문제에 대해 피해가 없더라도 최소한 효과가 떨어지는 의약품을 허가당국을 믿고 사용한 환자들을 향한 사과와 반성, 제대로 된 의학적 설명이 당연히 필요하다”고도 했다.
건약은 “식약처는 인보사사태 초기에도 안전성에 대한 큰 우려가 없다고 했다가 여론의 뭇매를 맞았다. 이번 메디톡신 사태에서도 GMP가 이뤄지지 않은 생산공장에서 조작된 원료로 만들어진 제품임에도 안전성에는 우려가 크지 않다는 근거 없는 장담을 하고 있다”면서 “보툴리눔톡신 제제는 그저 안전한 의약품이 아니며 기본적으로 보툴리눔은 생물테러무기의 사용에 대한 우려 때문에 국제생물무기금지 협약에 의해 관리되는 품목이기 때문“임을 언급했다.
그리고 미국은 이런 제제의 안전점검을 ‘허가제’로 철저히 감시하고 있다는 비판이다.
더 큰 문제는 “피해를 입은 환자에 대한 식약처의 대응이 빠져있다는 것”임을 지적했다.
“수많은 사람들이 투여받았을 불량 보톡스의 유통 판매 책임은 오로지 메디톡스에 있는 것이냐”는 건약은 “식약처의 부실검증이라는 의혹이 있음에도 마땅히 가져야 할 책임에 슬쩍 빠져있는 것이다. 식약처는 조작된 자료에 대한 별다른 검증을 하지 않다가 결국 내부고발자의 신고와 검찰의 수사를 통해 메디톡스의 불법행위가 드러난 사태”라며 “왜 식약처는 제약사가 현장실사 등을 통해서 제출한 자료를 검증하지 않느냐”고 강하게 몰아붙였다.
건약은 “이번 사태는 처음이 아니다. 작년에 인보사 사태를 기억한다. 무릎 관절염을 치료한다던 유전자세포치료제는 사실 종양유발이 가능한 세포로 이루어져 있었고, 주사치료를 받은 환자들은 지금도 불안에 떨고 있다”며 “문제의 원인은 결국 식약처가 규제기관으로서의 역할과 책임을 다하지 않았기 때문이었다”고 맹렬한 공세를 멈추지 않았다.
메디톡스는 지난 2012년 12월부터 지속·반복적으로 허가되지 않은 원료(원액)를 사용하고, 표시 함량(역가)을 조작해 식약처의 승인을 받아 판매했다. 2013년과 2015년에 허위로 제출된 자료로 승인된 수량만 32만 6769바이알에 달한다. 이는 약 130만 명에게 미용 시술을 제공할 수 있는 양이다.
한편 美FDA는 2009년부터 보톡스로 인한 사망 등 심각한 부작용을 우려해 최고수준의 경고 ‘박스 경고(boxed warning)’를 하고 안전성 관리를 하고 있다. 메디톡신주 부작용은 호흡마비, 삼킴곤란, 아나필락시스, 심혈관계 이상반응 등이다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

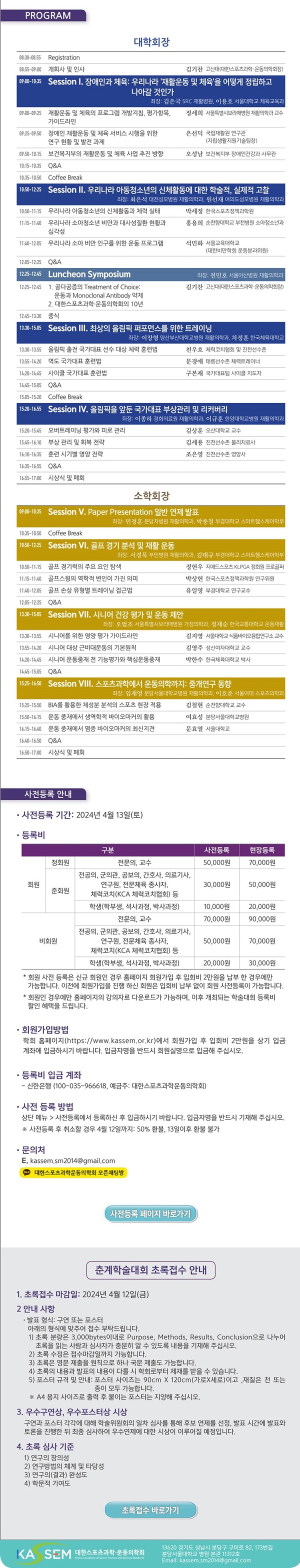 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
