4월 인플루엔자진단시약 평가 가이드라인 등 13종 통.폐합...6월 임상적 성능 평가 방안 마련
차지훈 체외진단기기과 주무관,4일 '올 체외진단의료기기 심사 추진방안' 발제
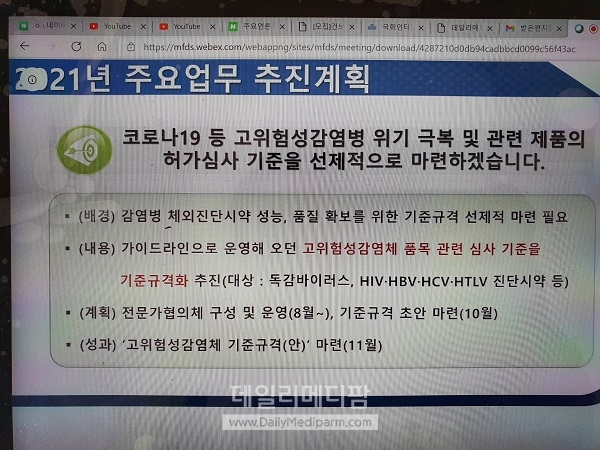 |
식약처는 오는 8월 코로나19등 감염병 체외진단시약 성능, 품질 확보를 위한 기준규격의 선제적 마련을 위해 전문가협의체를 구성, 운영하고 10월 기준규격 초안을 마련할 방침이다.
또 4월 중에 앞서 발간된 고위험성감염체 관련 인플루엔자진단시약 평가 가이드라인 등 13종 통.폐합과 성능 기준 전면 정비를 위한 전문가협의를 구성 운영하고 6월 임상적 성능 평가 방안 마련이 진행된다.
이어 7월 고위험성감염체 진단시약 가이드라인 재정비에도 나설 계획이다.
차지훈 식약처 체외진단기기과 주무관은 4일 비대면으로 진행된 설명회에서 '올 체외진단의료기기 심사 추진방안'이란 발제에서 이같은 '2021년 주요업무 추진계획'을 밝혔다.
식약처는 또 "독감 백신 콜드체인 유통 문제가 대두돼 체외진단 제품 보관 환경뿐아니라 유통환경까지 안정성 강화의 필요성이 있다"며 "오는 7월 시약 운송 과정의 환경 조건(유통 스트레스)를 고려한 운송 안정성 평가 방안이 마련된다"고 밝혔다.
이런 내용은 8월 체외진단의료기기 허가심사 규정 해설서에 담길 예정이다.
 |
또한 개인용혈당측정기, 임신진단키트 등 자가 사용 제품 개발이 증가함에 따라 이같은 IVD제품의 특성을 고려한 심사 방안의 선제적 마련이 필요하다며 3월 전문가협의페 구성 운영하고 9월 사용자 적합성 평가 방안을 마련해 10월 자가 사용 체외진단의료기기 허가심사 가이드라인에 반영토록 개정에 나설 방침이다.
이어 인공지능 기술 기반의 체외진단 소프트웨어 제품 개발이 증가함에 따라 6월 인공지능 디지털 병리 제품의 허가시 제출 자료 안내, 임상적 성능 평가시 유효성 평가 변수 예시 등 허가 심사 가이드라인을 제정할 예정이다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
