이물 발견된 사실-조사 결과 및 조치 계획 등
소프트웨어 의료기기 수입업자의 시설기준 정비
1·2등급 수출용 의료기기 허가절차 개선
식약처, '의료기기법 시행규칙'(총리령) 개정안 입법예고
 |
올해부터 의료기기 중 이물 발견시 관련 사실 공표를 위한 세부 절차가 마련되며 의료기기 품목 갱신 첫 신청 시점인 5월부터는 제조·수입허가·인증·신고 갱신 수수료가 신설된다.
식품의약품안전처(처장 오유경)는 이런 의료기기 중 이물 발견 사실을 공표하는 세부적인 절차와 소프트웨어 의료기기 수입업 시설기준을 완화하는 내용 등을 담은 '의료기기법 시행규칙'(총리령) 개정안을 입법예고했다고 4일 밝혔다.
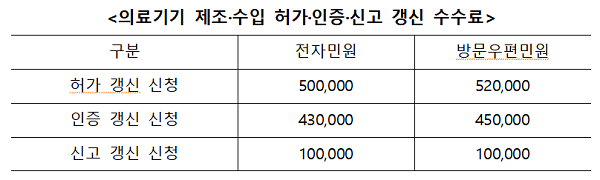
개정안의 주요 내용은 ➊의료기기 중 이물 발견 사실에 대한 공표 세부 절차 마련, ➋소프트웨어 의료기기 수입업자의 시설기준 정비, ➌1·2등급 수출용 의료기기 허가절차 개선, ➍제조·수입허가 등 갱신 수수료 신설이다.
구체적으로는 ➊인체에 직·간접적으로 접촉하는 부위에서 이물*이 발견돼 국민건강의 위해 방지를 위해 지체 없이 알릴 필요가 있는 경우, 식약처장은 이물 혼입 원인 조사 결과 보고일로부터 3일 이내에 식약처 누리집을 통해 이물이 발견된 사실, 조사 결과 및 조치 계획을 공표할 수 있도록 했다.
또 무형의 제품인 소프트웨어의 특성을 반영해 소프트웨어 의료기기만 수입하는 수입업자는 창고 및 실험실을 갖추지 않아도 된다.
또한 국내 의료기기 제조 기업의 수출을 지원하기 위해 수출용 의료기기에 한해서 1·2등급 허가 대상을 신고·인증 대상으로 전환된다.
이어 의료기기 품목 갱신 제도 시행에 따른 첫 신청 시점인 5월이 도래함에 따라 갱신 수수료가 신설된다.
식약처는 앞으로도 규제과학 전문성을 기반으로 효과 있고 안전한 의료기기를 국민께 공급하고 안전을 침해하지 않는 범위 내에서 산업 활성화하기 위해 규제를 합리적으로 개선하겠다고 밝혔다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 한국한의약진흥원, 한의약 산업 전문가 양성에 나선다
한국한의약진흥원, 한의약 산업 전문가 양성에 나선다
