알테오젠, NexP 융합 원천 기술에 지속형 인간 성장호르몬 임상 2상 개시
항체의약품 바이오베터 개발 대표기업인 ㈜알테오젠(대표이사 박순재)이 국내 3개 대형 대학병원의 임상시험심사위원회(IRB, Institutional Review Board)로부터 임상2상 승인을 받았다고 최근 밝혔다.
 |
신약에 대한 임상시험을 하기 위해서는 IRB를 거쳐야 하며, 임상심의위원회에서는 기존의 임상 데이터와 새로운 임상시험계획서가 제대로 되었는지를 확인하고, 만약에 있을지도 모르는 부작용에 대한 검토와 임상시험을 할 때 도덕적, 윤리적으로 어느 수준까지 용인할지 여부를 판단하는 중요한 역할을 한다.
이번 임상시험은 성인 성장호르몬결핍증(AGHD) 환자를 대상으로 ALT-P1(재조합 지속형 인간 성장호르몬)을 4 주 투여 후, 약동학/약력학 및 안전성 평가를 위한 공개, 단일군, 병행, 다기관 임상2상 시험이다.
특정 단백질을 약물과 결합시켜 체내 지속성을 높이는 기술인 알테오젠의 NexPTM 플랫폼 기술은 미국, 유럽, 중국 일본 등 전세계 11개 국에서 이미 특허를 받은 기술로 이 기술에 지속형 성장호르몬을 적용시켜 적은 용량으로 약효를 지속할 수 있는 특징을 나타낸다.
알테오젠의 정경훈 연구소장은 “지난 9월 내분비계 중심 미국 바이오제약사인 버사티스(Versatis)가 지속형 소아 성장호르몬제제 소마바라탄이 3상 임상에서 일차 평가변수를 충족하지 못했다고 밝힘에 따라 지속형 성장호르몬의 투여량에 대한 관심이 증가 하고 있다”면서“지속형 인간성정장호르몬의 성공을 위해서는 공간적 방해를 극복해야 하며, 이는 용량이 얼마나 적게 들어가면서 효능을 낼 수 있느냐가 임상 3상 성공의 승패를 좌우할 수 있다. 본 특허로 등록된 알테오젠의 기술은 타사의 개발의 용량에 비해 10~50% 수준의 적은 량으로 임상 3상 성공 가능성이 크다"고 밝혔다.
한편 ㈜알테오젠은 2014년 12월 코스닥에 상장한 항체의약품 바이오베터 개발 대표기업으로, 지속형 플랫폼 기술인 NexPTM 와 항체-약물접합(ADC) 의 원천기술인 NexMabTM과 개발하였고 이를 기반으로 바이오베터 치료제를 개발하고 있다.
성장호르몬의 세계시장규모는 약 4조, 국내는 약 800억원으로 추산된다. 최근 국내 5개년 매출 성장률이 7%로 꾸준한 성장세를 기록하고 있으며, 소아 성장호르몬 결핍증 뿐만 아니라, 터너증후군과 관련된 단신증, 만성신부전증 및 성인의 성장호르몬 결핍증이나 노화예방으로도 적용범위를 확대할 수 있는 시장 성장 잠재력이 매우 큰 분야이다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

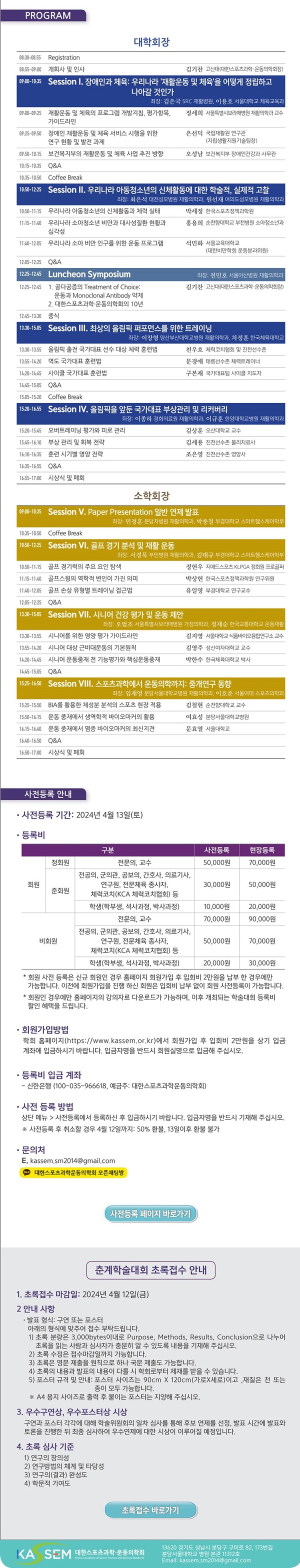 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
