 |
식약처는 28일 허가 당시 제출 자료가 허위로 판명난 '인보사'의 허가 당시 2차 중앙약심위원회 일부 위원을 배제했다는 지적에 대해 "지난 2017년4월에 개최된 1차 중앙약심 자문결과와 지난 2013년 7월에 열린 3상 임상시험 계획 승인 시 실시한 중앙약심 자문결과가 서로 상충됐다"며 "이에 2017년 6월에 열린 2차 중앙약심위 위원은 '인보사' 유효성에 대한 이견 해소와 종합적인 자문을 받기 위해 포괄적으로 구성하게 됐으며 이 과정에서 특정위원 배제는 전혀 없었다"고 일축했다.
결국 1차 중앙약심의 참석위원과 3상 임상시험 계획을 승인한 위원을 모두 포괄해 인보사의 유효성에 대한 종합적인 자문을 받고자 2017년 6월 2차 중앙약심을 개최하게 된다.
이를 위해 지난 2017년 4월 1차 중앙약심 위원 전원과 3상 임상시험 계획 승인을 위한 2013년 7월 중앙약심 참석 위원 일부를 위촉했고 위원회 정족수를 채우기 위한 신규 위촉이 있었을 뿐, 이 과정에서 특정위원 배제는 없었다는 것이다.
즉 1차 중앙약심 참석위원 7명 전원을 위촉했지만 이중 4명만이 참석했으며 위원 3명은 개인 일정 등의 사유로 불참했고 불참위원 중 1명은 서면으로 의견을 사전에 제출했다고 식약처는 밝혔다.
또 3상 임상시험 계획 승인을 위한 중앙약심(2013년7월) 참석위원 8명 중 세포유전자치료제 전문가 2명과 정형외과 전문의 2명 등 4명을 위촉했고 4명 모두 참석했다.
이어 제척·기피사유에 해당하지 않는 상임위원 2명과 비상임위원 1명 등 신규 위원 3명을 위촉했고 이들 3명 모두가 회의에 참석했다.
이는 상임위원의 수가 전체 1/2을 상회해야 한다는 규정에 따른 조치였다.
식약처는 "총 14명을 2차 중앙약심위원으로 위촉했으며 이중 11명이 참석했다"고 설명했다.
한편 지난 2013년7월 개최된 3상 임상시험 계획 승인 시 실시한 중앙약심에서는 골관절염치료제로서 연골구조 개선이 없더라도 관절기능 및 통증 개선이 1년 이상 관찰되면 유전자치료제의 유효성으로 적절하다고 보아, 임상시험 계획을 같은해 8월 승인했다.
반면 지난 2017년4월의 1차 중앙약심에서는 골관절염의 유전자치료제는 연골의 구조개선 없이 증상완화 즉 기능 및 통증 개선만으로는 유효성을 인정할 수 없다고 자문해 충돌을 빚었다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

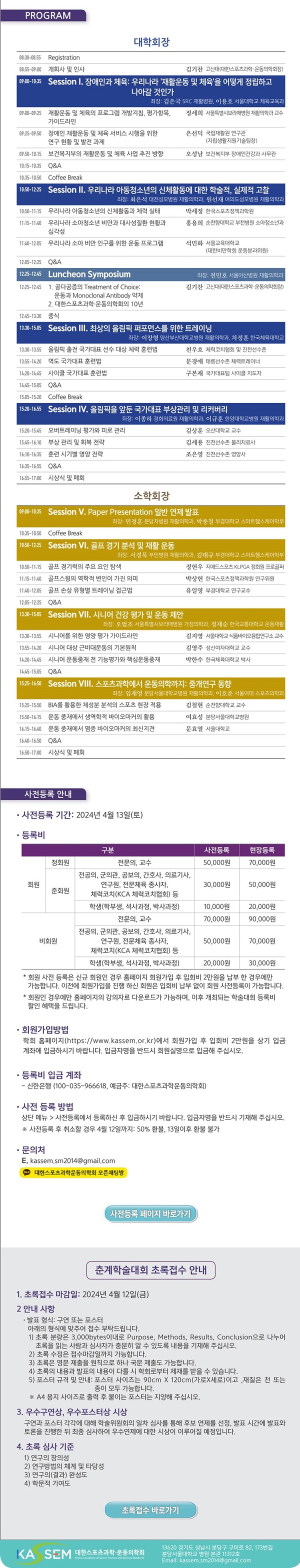 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
