美FDA-유럽 집행위원회(EC) '엑시티닙'경구제 관련 안전성 정보 근거
 |
한국화이자제약(주) 신세포암치료제 '인라이타정1mg, 5mg' 등 엑시티닙제제에서 이상반응 '동맥류 파열'이 추가 보고됐다.
이는 소라페닙 대조 무작위배정 임상시험에 참여한 진행성 신세포암 환자 중 엑시티닙에 노출된 359명의 자료를 반영한 것이다.
식약처는 이같은 내용의 美FDA 및 유럽 집행위원회(EC)의 '엑시티닙'경구제 관련 안전성 정보에 대한 검토결과에 따라 허가사항 변경안을 마련했으며 검토의견이 있는 경우 해당 사유 및 근거자료를 7월5일까지 제출해 줄것을 21일 주문했다.
허가사항 변경안에 따르면 소라페닙 대조 무작위배정 임상시험에 참여한 진행성 신세포암 환자 중 엑시티닙에 노출된 359명의 자료를 반영한 결과 가장 흔한 이상 반응은 설사, 고혈압, 피로, 식욕저하, 오심, 발성 장애, 손-발의 홍반성 감각이상 증후군였으며 동맥류파열이 추가 보고됐다.
동맥류 파열 사례(기존의 동맥류 포함)가 보고됐는데 일부는 치명적이었다. 기존의 동맥류 병력이 있는 환자에게 이 약으로 치료하기 전에 동맥류 파열의 위험을 주의 깊게 고려해야 한다.
또 가임여성에게 이 약 투여 중 그리고 마지막 투여 후 1주일까지 효과적인 피임법을 사용하도록 권고해야 한다는 임부 및 수유부에 대한 허가사항 변경안을 신설했다.
이인선 기자 eipodo@naver.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

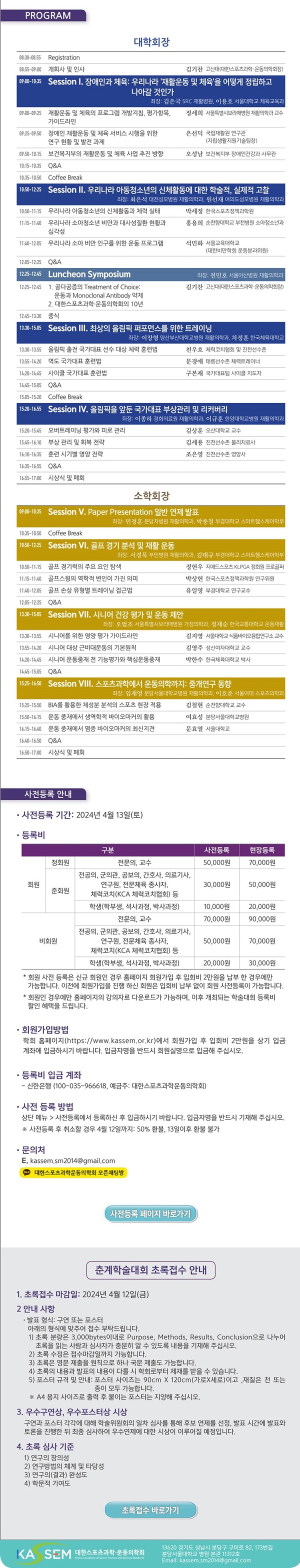 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
