원료약 등록제도 보고기한 합리화하는 등 현행 제도 일부 미비점 개선·보완
 |
앞으로 제조업, 수입업 및 품목허가·신고 등을 거짓이나 부정한 방법으로 받은 경우 허가 취소될 전망이다.
또 원료약 등록제도의 보고기한을 합리화하는 등 현행 제도 운영상 나타난 일부 미비점이 개선·보완된다.
식약처는 이런 내용의 '의약품 등의 안전에 관한 규칙' 일부개정령안을 입법예고했다고 29일 밝혔다.
일부개정안에 따르면 의약품 등의 제조업, 수입업 및 품목허가·신고, 임상시험계획승인, 국가출하승인 등을 거짓이나 그 밖의 부정한 방법으로 받은 경우에 행정처분 기준이 신설된다. 그 밖에 제조·시험 지시서 및 기록서 등 미작성하거나 거짓으로 작성한 경우 등에 행정처분의 세부 기준도 개선된다.
또 모든 등록대상 원료약에 대해 매년 1월 31일로 정하고 있는 등록사항 변경보고 기한을 각 원료약 최초 등록일 전월 말일을 기준으로 역산해 1년 간의 변경내용에 대해 보고하는 것으로 전환함으로써 업무처리의 효율성을 높였다.
또한 국가필수의약품의 적시 공급을 지원하기 위해 희귀약 등과 마찬가지로 국가필수약의 경우도 국내 대체약 없어 공급중단시 환자 치료에 차질이 발생할 우려가 있는 경우, 원 제조원의 시험검사 성적서로 수입자의 시험검사 성적을 갈음할 수 있도록 허용해 국내 환자의 치료 공백을 최소화했다.
이어 2019년11월18일 입법예고했던 ‘인체에 직접 적용하지 아니하는 제품(소독제 등)’에 대한 의약품 제조 및 품질관리 기준을 적용하도록 하는 개정 규정의 시행일을 공포 후 2년에서 공포 후 1년으로 하고 기존 의약품 제조업자 등에 대한 경과조치 기간 역시 시행 후 2년에서 1년으로 단축함으로써 의약품의 안전 및 품질관리를 강화했다.
식약처는 이 제정안에 대해 의견이 있는 기관․단체 또는 개인은 2020년 8월 28일까지 통합입법예고시스템(http://opinion.lawmaking.go.kr)을 통해 온라인으로 의견을 제출하거나 의견서를 식약처장에 제출해 둘것을 주문했다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

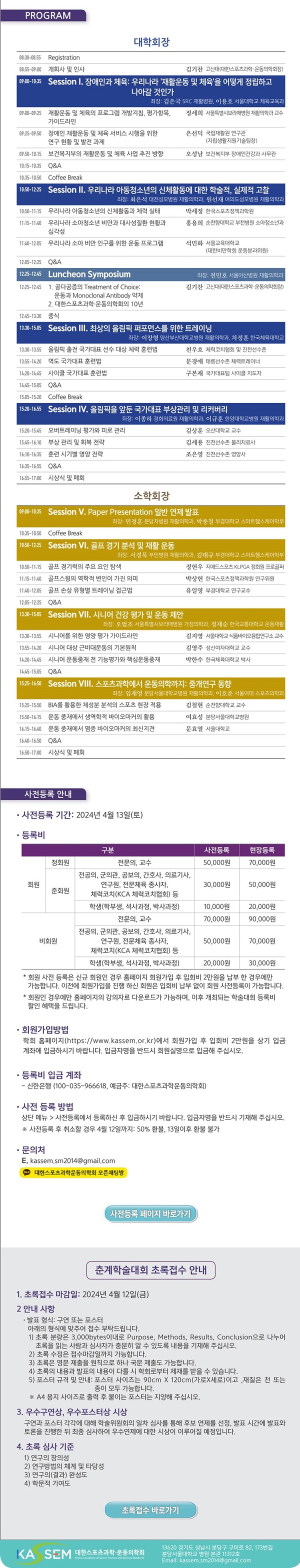 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
