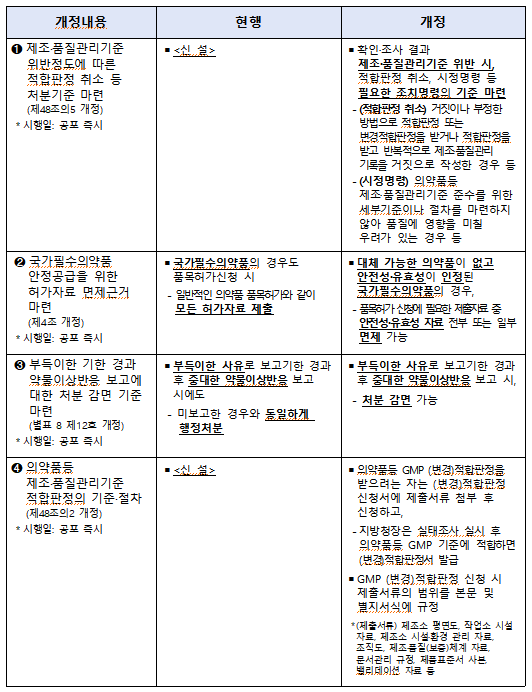
제조·품질관리기준 준수 세부 기준·절차 위반시 '시정명령' 등 처분 기준 마련
국가필수약 안정적 공급 위한 허가자료 면제 근거도 마련
 |
 |
앞으로 제약사가 자사품목의 제조·품질관리기준 적합 판정 또는 변경적합판정을 거짓·부정하게 받거나 반복적으로 제조·품질관리 기록을 거짓·잘못 작성한 경우 해당품목의 적합 판정이 취소된다.
또 품목 제조·품질관리기준 준수 세부 기준이나 절차를 마련하지 않아 품질에 영향을 미칠 우려가 있는 경우 시정명령을 하는 등 제조·품질관리기준 위반 시 처분기준이 마련됐다.
또한 국가필수약의 안정적 공급을 위한 허가자료 면제 근거가 마련된다. 이는 즉시 시행된다.
다만 약물이상반응 보고시 부득이하게 보고기한을 경과한 경우 처분 감면 근거도 마련된다. 이 제도는 즉시 시행된다.
식품의약품안전처(처장 오유경)는 중대한 의약품등 제조·품질관리기준(GMP) 위반 시 제조·품질관리기준 적합 판정을 취소하는 내용 등을 담은 '의약품 등의 안전에 관한 규칙' 총리령 개정령을 2022년 12월 29일 개정·공포했다고 밝혔다.
주요 개정내용에 따르면 종전에는 국가필수약도 품목허가 신청시 모든 허가자료를 제출해야 하나, 앞으로는 대체 가능한 의약품이 없고 안전성과 효과성이 인정된 의약품의 경우 안전·유효성 심사 자료 일부 또는 전부의 제출을 면제할 수 있는 근거를 마련됐다.
앞서 식약처장은 중앙약사심의위원회의 의견을 들어 안전·유효성이 충분히 확보됐다고 인정한다. 국가필수약 안정공급을 위한 허가자료 면제 근거 마련은 ‘식의약 규제혁신 100대 과제’(99번 과제)로서 국민 불편·부담과 절차적 규제를 개선하기 위해 추진한 사항이다.
또 종전에는 품목허가를 받은 자가 중대한 약물이상반응을 알게 된 날부터 15일 이내에 보고해야 하나, 앞으로는 천재지변 등 부득이한 사유로 기한을 경과해 보고한 경우 처분을 감면할 수 있게 된다.
식약처는 이번 개정안이 고품질의 의약품을 생산하고 국내 의약품의 국제 경쟁력을 높이는 데 도움을 줄 것으로 기대하며, 앞으로도 규제과학 전문성을 바탕으로 안전하고 효과적인 의약품이 국민에게 공급될 수 있게 하겠다고 밝혔다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 5월 ‘청년내일저축계좌’ 신규 모집 개시...34세 이하 청년 대상
5월 ‘청년내일저축계좌’ 신규 모집 개시...34세 이하 청년 대상
