셀리드社 '바이러스전달체 백신' 1상-유바이오로직스社 '합성항원백신' 1상-제넥신 'DNA 백신' 2상 진행
삼성서울병원 등 10개 의료기관서 아스트라제네카.화이자 백신 접종후 단기 부작용-항체형성율-항체기간 평가 예정
 |
국립감염병연구소는 4일 국내 백신 개발은 SK바이오사이언스 '합성항원백신', 진원생명과학 'DNA백신', 셀리드社 '바이러스전달체 백신'과 유바이오로직스社 '합성항원백신', 제넥신 'DNA 백신' 등 5개사가 임상계획 승인을 받아 1/2상 임상시험을 진행하고 있다고 밝혔다.
장희창 국립감염병연구소장은 이날 질병관리청 브리핑실서 연 코로나19 발생 현황 및 예방접종 경과 설명회에서 이같이 밝혔다.
장 소장은 "백신 개발 연구 사항에 따르면 국내 백신 개발은 현재 1~2상 임상시험단계에 와 있으며 SK바이오사이언스 합성항원백신, 진원생명과학의 DNA백신의 1상 임상을 진행 중"이라며 "셀리드社의 바이러스전달체 백신과 유바이오로직스社의 합성항원백신이 1상 임상단계에 진입했다"고 밝혔다.
또 제넥신 DNA 백신은 2월26일부터 2상 임상시험을 진행 중이라고 설명했다.
장 소장은 "SK 바이오사이언스, 진원생명과학 및 셀리드社의 임상시험에 참여한 환자 검체를 위탁받아 백신 접종 후 항체가 및 세포면역형성 여부를 평가하고 있다"며 "앞으로도 국내 중앙실험실 역할을 수행하면서 백신개발을 지속 지원할 예정"이라고 말했다.
장 소장은 "국내 백신의 경우 국내 임상 참가한 환자의 혈액 검체로 변이주에 대한 중화반응을 평가할 계획"이라며 "신종 감염병 및 변이 바이러스에 대응할수 있는 백신은 mRNA백신이다. 변이 바이러스 출현 및 다음 신종 감염병 판데믹에 신속하게 대응하기 위해 우리나라도 mRNA백신을 개발해야 한다고 판단하고 있다"고 말했다.
장 소장은 "지난해에 이어 2월25일 모더나社, 3월3일 美국립알레르기감염병연구소와 2차 화상회의를 진행했고 mRNA백신 개발에 상호 협력하고 기타 감염병 대해 공동연구를 진행키로 했다"고 말했다.
장 소장은 "범 정부지원위원회 산하 실무추진위원회에 mRNA분과 위원회를 새로 설립해 대학의 연구자와 기업이 협력하는 범정부사업단을 추진해 나갈 것"이라고 말했다.
또 "국내에서는 아스트라제네카 백신과 화이자 백신이 먼저 도입돼 접종이 시작된 상태다. 국립감염병연구소는 삼성서울병원, 서울아산병원, 분당서울대병원 등을 포함한 10개 의료기관에 아스트라제네카 백신 접종 의료인 200명과 화이자 백신 접종 200명에 대해 단기부작용 및 항체형성율, 항체기간을 평가할 예정이며 그 결과를 국민들께 알릴 것"이라고 밝혔다.
이어 추후 도입될 백신들도 같은 연구를 진행해 그 결과를 제공할 예정이다.
천관욱 기자 car2080@korea.com
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

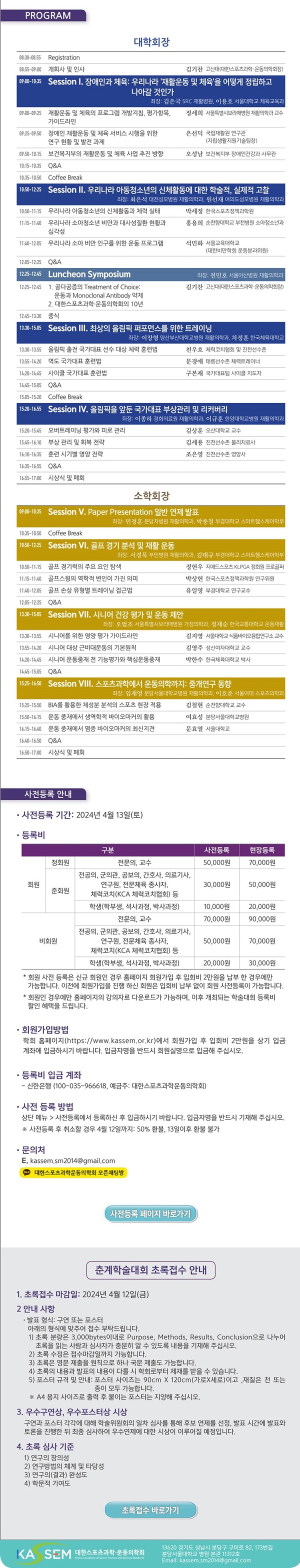 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
