메토트렉세이트(경구),(주)유한양행 '유한메토트렉세이트정’ 등 9개 업체 13개 품목
독소루비신(용액주사) ‘일동제약(주)일동아드리아마이신알.디.에프.주사10밀리그램(독소루비신염산염)’ 등 10개 업체 25개 품목
만니톨(주사)‘제이더블유중외제약(주) 중외25%만니톨주사액’ 등 3개 업체 8개 품목
식약처,‘메토트렉세이트(경구)’ 등 3개 성분(46개 품목) 허가사항에 이상사례 추가 안전조치 실시
백혈병, 류마티스관절염 등 치료에 사용되는 항암제 성분 ‘메토트렉세이트(경구)’는 류마티스관절염 치료를 위해 해당 제품 복용 중 B형간염 재활성화돼 간염이 빠르게 진행된 사례가 있어 허가사항(사용상의 주의사항)에 ‘B형간염 재활성화’가 추가된다.
 |
또 악성 림프종, 소화기암 등 항암제 성분 ‘독소루비신(용액주사)’은 빈크리스틴 등의 항암제와 병용투여 후 면역저하로 폐렴이 발생한 사례가 있어 사용상의 주의사항에 ‘폐렴'이 추가된다.
또한 수술중, 수술후, 외상후의 급성신부전의 예방 및 치료 당류제 성분‘만니톨(주사)’이 두개(頭蓋) 내에 압력 조절을 위해 만니톨을 투여한 후 지속적인 나트륨 상승을 보여 사용상의 주의사항에 ‘고나트륨혈증'이 추가됐다.
식약처(처장 류영진)는 국내 시판 후 중대한 이상사례를 분석·평가해 항암제 ‘메토트렉세이트(경구)’ 등 3개 성분(46개 품목)의 허가사항에 새로운 이상사례를 추가하는 안전조치를 실시했다고 20일 밝혔다.
중대한 이상사례는 ▴사망을 초래하거나 생명을 위협하는 사례 ▴입원 또는 입원기간의 연장이 필요한 사례 ▴지속적 또는 중대한 불구나 기능저하를 초래하는 사례 ▴선천적 기형 또는 이상을 초래하는 사례 ▴그 밖에 의학적으로 중요한 상황이 발생하여 치료가 필요한 사례
이번 조치는 의약품 사용 후 보고된 이상사례 중 중대한 이상사례 정보를 한국의약품안전관리원이 별도로 분석·평가한 실마리정보를 바탕으로 중앙약사심의위원회의 자문을 거쳐 최종 결정됐다.
주요 조치 내용은 ▲항암제 성분 ‘메토트렉세이트(경구)’과 ‘독소루비신(용액주사)’ 제제의 이상사례를 허가사항에 추가 ▲당류제 성분 ‘만니톨(주사)’ 제제의 이상사례를 허가사항에 추가다.
‘메토트렉세이트(경구)제제는‘(주)유한양행 유한메토트렉세이트정’ 등 9개 업체 13개 품목, 독소루비신(용액주사) ‘일동제약(주)일동아드리아마이신알.디.에프.주사10밀리그램(독소루비신염산염)’ 등 10개 업체 25개 품목, 만니톨(주사)‘제이더블유중외제약(주) 중외25%만니톨주사액’ 등 3개 업체 8개 품목이 해당된디.
식약처는 "이번 조치가 이들 의약품을 사용하는 의약전문가 및 환자들에게 중대한 이상사례 발생 등에 대한 정보를 사전에 알려 국민들이 안전하게 의약품을 사용하는데 도움이 될 것"이라며 "앞으로도 중대한 이상사례 등을 지속적으로 분석·평가하여 필요한 안전조치를 실시하겠다"고 밝혔다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

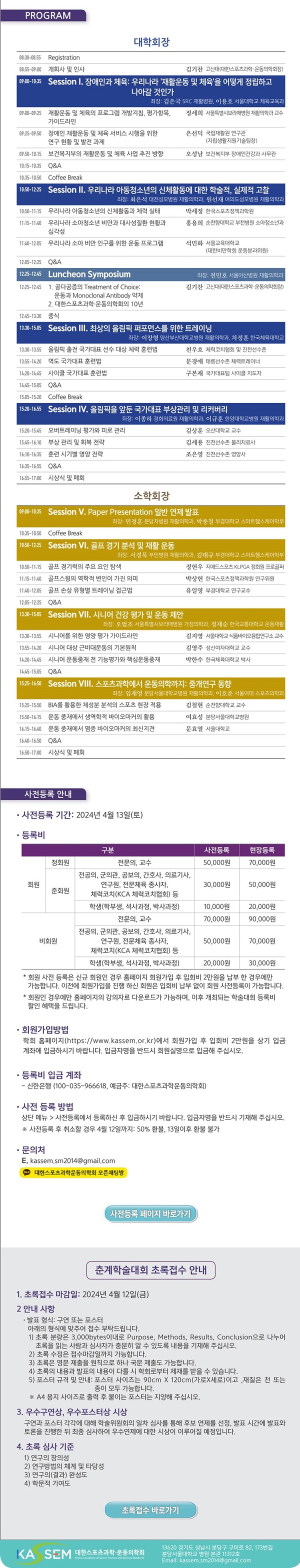 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
