희귀질환관리법前 약사법 적용 허가후 유효기간 부여 희귀약갱신 절차 거쳐야
식약처, '허가 신고 갱신제도 운영현황' 유효기간 관련 질의 응답
 |
수출용의약품으로 허가받은 의약품을 국내 시판을 목적으로 내수용으로 변경허가를 하는 경우 유효기간은 변경한 날부터 5년이지만 희귀약의 품목허가 유효기간은 10년까지 부여된다.
식약처 이주헌 의약품관리과 연구관은 11일 세종대 컨벤션홀에서 열린 식약처 식품의약품안전평가원 주관으로 열린 '의약품 허가.신고 갱신 및 제품화 지원 민원 설명회'에서 '허가 신고 갱신제도 운영현황'이란 발제를 통해 희귀약의 유효기간은 어떻게 되느냐는 질문에 대해 응답집을 통해 이같이 답했다.
수출용의약품 및 희귀약의 유효기간에 대해 "수출용의약품으로 허가받은 의약품은 국내 시판을 목적인 내수용으로 변경 허가를 하는 경우 유효기간은 변경한 날로부터 5년이며 희귀약은 '희귀질환괸리법' 제19조제3항에 따라 '약사법' 제 31조의 5 제1항 규정에도 불구, 품목허가의 유효기간을 10년으로 부여할수 있다.
그는 또 '2013년 이후 희귀질환관리법이 제정되기 전에 허가받은 희귀약의 유효기간은 5년인데, 허가 신고 갱신에 따라 유효기간이 변경되는지에 대한 질문과 관련 "희귀질환관리법 이전에 이미 약사법에 따라 허가받고 유효기간이 부여된 희귀약은 해당 유효기간에 따라 갱신을 받아야 한다고 답했다.
또한 재심사 대상 의약품의 유효기간은 재심사 기간이 끝난 후부터 적용되는데, 최초 허가시 의약품에 부여된 재심사 기간이 끝난후 ㅜ가 재심사를 받는 경우 유효기간 산정에 대해 "'약사법' 제31조의 5 제2항에 다라 재심사 대상 의약품이 유효기간은 재심사 가간이 끝난후부터 적용하도록 정하고 있다"며 "같은 법 제32조에서 재심사 대상 의약품은 그 품목 허가를 받은날로부터 품목에 따라 재심사 기간 4년에서 6년을 정하고 있다. 따라서 최초 의약품 허가 시 부여된 유효기간, 즉 재심사 가간이 끝난후부터 5년 적용의 원칙에 따라 갱신을 받아야 한다고 설명했다.
의약품 재심사제도는 품목 확를받고 유통되는 신약의 안전성 유효성에 대해 일정기간(6년 또는 4년) 사용 실적 등 을 토대로 재심사하고 그 결과에 따라 해당 의약품의 허가관리를 위해 도입한 제도다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

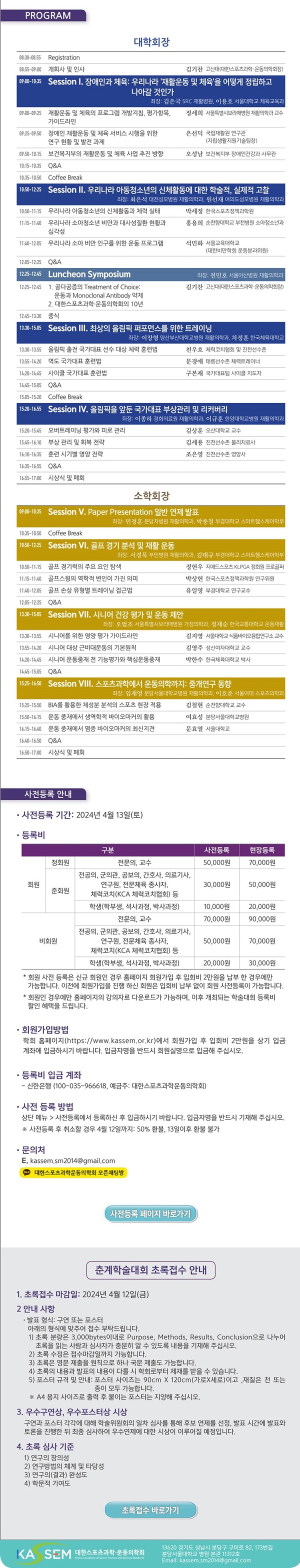 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
