안전 우려 등 필요시 수입 중단 조치 근거 마련
식약처 신진영 주무관, 29일 '인체조직 해외제조원 등록제 추진계획'밝혀
 |
| ▲식약처가 제시한 인체조직법 해외 및 타법 사례 |
오는 12월 12일 부터 해외에서 수입되는 인체조직에 대한 안전성 정보를 체계적으로 통합 관리하게 되며 그에 따른 문제가 우려되는 경우 식약처장은 즉시 수입 중단 조치를 취할수 있게 된다.
식약처 바이오의약품품질과 신진영 주무관은 29일 중구 상공회의소에서 열린 '2019 인체조직안전관리 정책설명회'에서 이같은 내용의 '인체조직 해외제조원 등록제 추진계획'을 밝혔다.
인체조직 해외제조원 등록제 추진계획에 따르면 그동안 개별 인제조직 수입 승인 사항 기반으로 수출국 제조원 기반 종합적인 정보 파악에 한계에 이르렀고 일부 조직은행이 계약 중단등 사유로 변경하지 않은 경우 동일 수출국 제조원에 대한 다른 정보 보유로 인한 해외 안전성 정보에 대한 적절한 조치를 취하기 어려웠던 게 현실이었다.
또 개별 수입승인 사항에 근거해 수출국 제조원 기반 안전성 문제가 발생하거나 실태조사 거부 또는 결과 부적합시 수출국 제조원이 취급하는 조직 전반에 대한 수입 중단 등 사후조치를 위한 근거가 미흡했다.
이에 수입승인된 조직의 해외 제조원애 대한 종합적인 정보 등록 및 체계적인 관리가 필요하고 안전성에 문제 있는 수출국 제조원의 수입 사용 중단 등 조치가 필요하다는 지적이다.
이에 따라 오는 12월 12일 시행예정인 인제조직법(제17조)에 따르면 조직은행외의 자는 조직을 수입해서는 안되며 조직을 수입하려는 조직은행장은 총리령을 정하는 바에 따라 조직마다 식약처장의 승인을 받아야 한다.
다만 승인받은 사항을 변경하는 경우에는 식약처장은 외국에서 수입되는 인체조직의 안전성 확보를 위해 해당 조직을 처리한 기관, 법인, 단체 등 수출국 제조원에 대한 실태조사를 할수 있다고 규정했다.
만일 수출국 재조원이 실태조사를 정당한 사유없이 거부하거나 실태조사 결과 위해 발생 우려가 있는 경우 해당 수출국 제조원의 조직에 대해 수입중단 조치를 취할수 있다.
 |
| ▲식약처 바이오의약품품질과 신진영 주무관 |
또한 인제조직을 수입하는 조직은행장은 조직별로 정하는 사항이 기록된 수입 조직 관련현황 자료를 작성해 이를 보관해야 한다.
인체조직법 17조2에 따르면 조직은행장은 승인받은 인제조직을 수입하려면 해당 조직의 수출국 제조원을 식약처장에게 등록해야 한다.
이어 조직은행장은 등록된 사항을 변경할 경우 식약처장에게 변경 등록을 해야 하며 변경 등록 절차와 방법 등 필요한 사항은 총리령에 정하고 있다.
수출국 제조원 등록제 등록 주체 및 대상은 조직수입업자이며 대상은 국내 허가된 조직은행이 수입 승인을 받은후 수입하고자 하는 수출국 제조원이다.
한편 해외 및 타법 사례로는 미국의 경우 인제조직을 취급하는 자국 및 외국 조직은행은 美FDA에 등록해 해당 조직은행명, 소재비, 등록번호 및 상태, 허가 사항에 대해 관리돼 있으며 수입 의약품.식품의 경우 해외제조소 등록과 현지실사, 수입중단 조항을 규정하고 있다.
최근 3년간 인제조직 수입량은 지난 2015년 28만178개에서 2016년 32만7459개, 2017년 58만2368개로 매년 증가추세다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

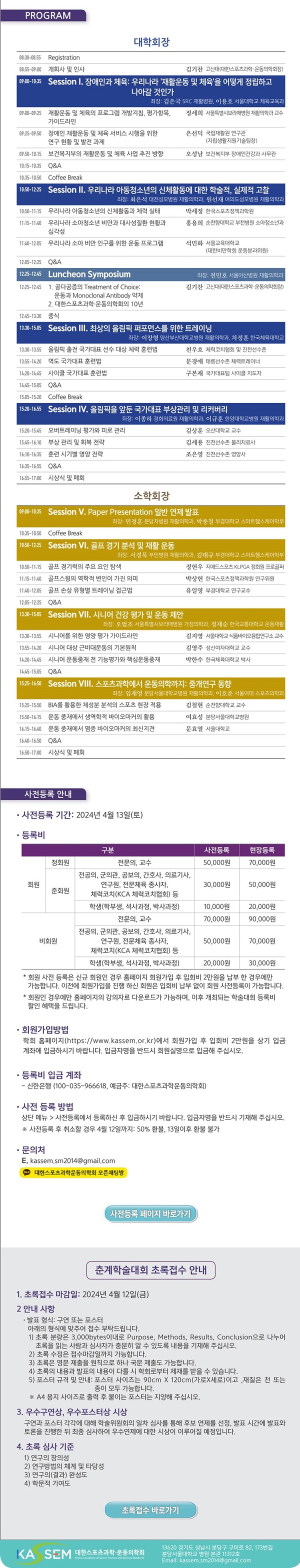 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
