국외 비임상시험실시기관 실태조사 경비.조사 근거 마련 등 규정 개정 마련
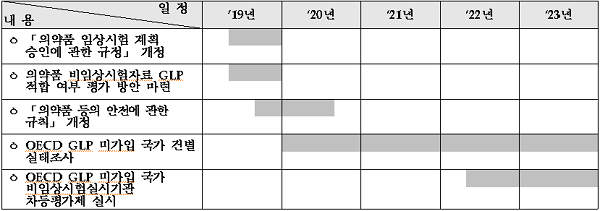 |
OECD GLP(비임상시험관리기준) 미가입 국가의 비임상시험실시기관 차등평가 방안이 2022년에 구축된다.
이를 위해 국외 비임상시험실시기관의 실태조사를 위한 경비 및 조사 근거 마련 등 규정의 개정이 추진된다.
비임상시험관리기준(GLP)은 의약품, 화장품, 화학물질 및 농약 등의 안전성 평가를 위해 실시하는 각종 독성시험의 신뢰성을 보증하기 위해 시험의 전 과정 및 결과에 관련되는 모든 사항을 조직적, 체계적으로 관리하는 규정을 말한다.
13일 식약처의 임상시험 발전 5개년 종합계획에 따르면 그동안 임상시험계획 승인신청 시 제출되는 비임상시험자료(독성시험자료)는 ‘비임상시험관리기준(GLP)’에 적합한 경우에만 인정해 왔다.
또 중국 등 OECD GLP 미가입 국가에서 수행한 비임상시험자료의 불인정으로 다국가 임상시험 진행 시 국내만 미참여하는 경우가 있었다.
하지만 최근 항암제, 희귀질환제 개발로 글로벌 신약개발 경향이 변화되면서 임상시험의 참여가 곧 치료기회로 이어지는 추세에다 중국 등에서 수행한 비임상시험자료를 근거로 하는 다국가 임상시험이 증가추세며, 미국, 유럽 등은 실태조사 등을 통해 중국의 비임상시험자료를 인정하고 있다.
이에 의약품 임상시험계획 신청시 제출하는 비임상시험자료의 요건 개정을 통해 OECD 미가입 국가의 비임상시험자료 제출를 허용하게 개선키로 했다.
식약처는 실태조사 결과 및 이력 등을 고려해 관리수준 별 OECD GLP 미가입 국가의 비임상시험실시기관 차등평가 방안이 오는 2022년에 마련키로 했다.
이를 위해 국외 비임상시험실시기관의 실태조사를 위한 경비 및 조사 근거 마련 등 규정개정을 추진키로 했다.
개선안에는 국외 비임상시험실시기관의 현지실사 소요 경비는 신청인이 부담되며 비임상시험자료의 신뢰성 확인을 위해 실태조사가 가능해 진다는 내용이 신설된다.
한정렬 기자 jrh05@hanmail.net
<저작권자 © 데일리메디팜, 무단 전재 및 재배포 금지>

 대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
대한스포츠과학·운동의학회, 오는 27일 ‘2024년 춘계학술대회’ 개최
